свищ на ноге что делать
Лечение лигатурного свища в Москве стоимость
Лечение лигатурного свища в Москве стоимость
Лигатурный свищ возникает вследствие воспаления и нагноения нерассасывающихся хирургических нитей, которыми с
шиты ткани (фасции и др.) при различных операциях.
При оперативных вмешательствах часть тканей (мышцы, подкожная клетчатка) сшивают рассасывающимися нитями, а часть (апоневроз, сухожилия и др.) – нерассасывающимися, т.к. такие ткани срастаются медленно и подвержены большим нагрузкам. Как правило, нерассасывающиеся нити навсегда остаются в тканях, не вызывая каких-либо проблем, но в редких случаях нагнаиваются, тогда в области нити появляется небольшой абсцесс, который вскрывается через маленькое отверстие на коже и формируется свищ.
Причины лигатурных свищей
Основная причина появления лигатурных свищей – инфицирование нити. Чаще всего оно происходит при операциях на полых органах – кишка, желудок, желчный пузырь и др. При этих вмешательствах просвет полых органов вскрывают и даже при самом корректном проведении операции инфицирования в той или иной степени избежать не удается. Иногда бывает, что инфицирование вызывается несоблюдением правил асептики при операции либо некачественным шовным материалом, но такие случаи довольно редки. Далее все зависит от агрессивности микроба, иммунного статуса организма. Если микробный агент агрессивен, а иммунных сил недостаточно для его подавления, происходит нагноение нити. Если нить нагноилась, то до отторжения нити гнойный процесс не прекращается, то обостряясь, то затихая.
Симптомы, диагностика лигатурного свища
Лигатурный свищ появляется в разные сроки после операции – от нескольких дней до нескольких месяцев и даже лет. В области послеоперационного рубца возникает покраснение, умеренные боли, может повышаться температура тела. Эти явления связаны с нагноением и появлением скопления гноя под кожей – лигатурного абсцесса. Через несколько дней абсцесс самопроизвольно прорывается на коже в области рубца, вытекает гной, и на коже остается небольшое отверстие с подтеканием мутноватой жидкости – это и есть лигатурный свищ. Если нагноилась не одна нитка, свищей может быть несколько. На фоне лечения свищ может закрываться, но если нитка не отторглась (не вышла наружу), свищ неизбежно открывается вновь. Так, периодически то открываясь, то закрываясь, свищ может существовать несколько месяцев и даже лет, пока нить не отторгнется сама, либо будет удалена хирургом.
Лечение лигатурного свища
При начальных проявлениях в виде лигатурного абсцесса производят небольшой надрез кожи для оттока гноя, т.к. ждать пока гной прорвется сам нецелесообразно в связи с риском нагноения окружающих тканей и формирования флегмоны – разлитого воспаления подкожной клетчатки. После вскрытия гнойника обычно пытаются вслепую достать зажимом лигатуру. Если это удается, то после очищения раны свищ закрывается навсегда. Если лигатуру достать не получается, назначают перевязки с мазью левомеколь, на фоне которых воспаление стихает, свищ может временно закрыться. При новом воспалении опять пытаются достать лигатуру, рано или поздно это удается. Можно сделать широкий разрез в области свища, попытаться найти воспаленную нить и удалить ее, но это не всегда получается, к тому же во время обширного вмешательства существует риск инфицирования соседних нитей с последующим формированием новых свищей.
Подводя итог вышесказанному, можно сказать, что лигатурный свищ – редкое осложнение полостных и других хирургических вмешательств, которое не опасно для жизни, но может беспокоить пациента довольно долго, вплоть до отторжения или удаления нагноившейся нити.
Трофическая язва. Причины, симптомы, диагностика и лечение венозной трофической язвы
Трофическая язва – это довольно неприятное и опасное заболевание, требующее квалифицированного лечения. В этой статье мы Вам расскажем о причинах появления язв, симптомах, диагностике и детально постараемся обсудить лечение трофических язв.
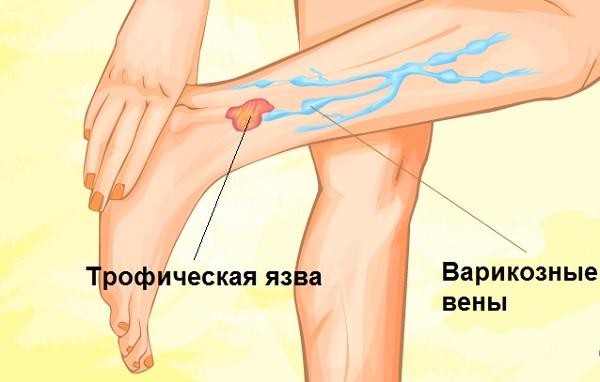
Трофическая венозная язва — что это такое?
Трофическая венозная язва
Причины появления трофической язвы на ноге
Трофическая язва всегда сопутствует другому серьезному заболеванию. Заболевания, способствующие появлению трофических язв:
Трофическая язва — это очень плохо!
Чаще язвы возникают на нижних конечностях, но возможно их появление на других участках тела и даже на слизистой. От обычной раны трофическую язву отличает следующее:
Если появилась трофическая язва нижних конечностей, лечение должно быть быстрым.
Трофические язвы не образуются спонтанно. Вначале появляется отечность, сопровождающаяся сильным зудом. Кожа истончается. Появляется пигментация или синюшность.
Множественные трофические язвы на ноге
Появление трофической язвы зачастую сопровождается ознобом и ночными судорогами икроножных мышц. Из-за застоя в лимфатических сосудах на остекленевшей поверхности кожи начинают появляться капельки жидкости. Далее очаги отслоившегося эпидермиса сливаются, и образуется язва с рваными уплотненными краями, вызывающая сильную боль при малейшем прикосновении. Как правило, язвенная поверхность быстро заселяется бактериями, кровоточащая язва начинает гноиться.
Почему трофическая язва появляется чаще на нижних конечностях?
Нижние конечности более всего подвержены появлению трофических язв. Это обусловлено замедленным кровотоком в сосудах ног. Лимфостаз и неполноценное питание тканей приводит к появлению обширных язв с грязным гнойным налетом. Это и есть трофическая язва нижних конечностей. Фото, симптомы, диета, профилактика – все этим вопросы стоит детально рассмотреть. Стоит отметить, что при сахарном диабете язвы появляются на большом пальце стоп и пятках.
Трофическая язва при варикозе
Более 70% случаев трофических язв обусловлены тяжелыми случаями варикозного расширения вен. Даже незначительное повреждение целостности кожных покровов при варикозе могут привести к образованию язв на лодыжках и голенях.
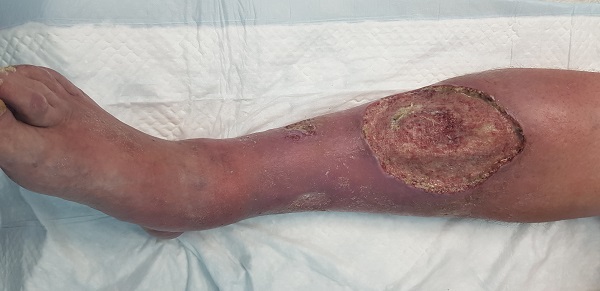
Большая трофическая язва на голени
Трофические язвы, расположенные на голени, говорят о серьезных изменениях более крупных венозных сосудов и распространении области с нарушенной иннервацией и плохим кровоснабжением. Трофическая язва голени обычно доставляет сильную боль.
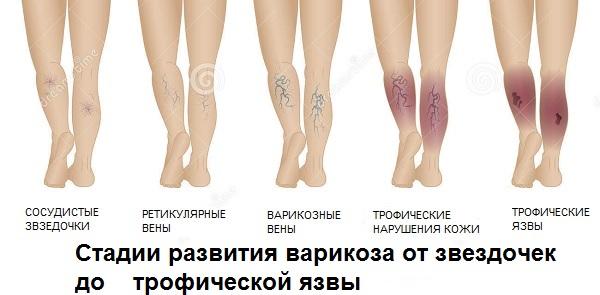
Трофическая язва, стадии или варианты течения
Стадии появления трофической язвы
Начальная стадия (кровоточащая язва небольших размеров) осложняется присоединением бактериальной и грибковой инфекции. Из язвы начинает отделяться гнойное содержимое с неприятным запахом. Чем длительнее процесс, тем более глубокие слои подвергаются воспалению и гниению. Язвенное поражение распространяется на икроножные мышцы, вовлекая в воспалительный процесс голеностопный сустав. В запущенных случаях возможно развитие пиодермии, флегмоны и сепсиса.
Стоит различать венозные и артериальные трофические язвы. Первые встречаются у пациентов любого возраста, тогда как артериальные язвы — недуг, встречающийся исключительно в пожилом возрасте, обусловленный атеросклерозом стенок артерий.
Трофическая язва, диагностика
При диагностике трофической язвы и выявлении причин ее возникновения применяются следующие лабораторные анализы:
Также врач назначает ряд необходимых исследований:
Для выбора эффективного лечения необходима консультация хирурга флеболога, специализирующегося на заболеваниях сосудов нижних конечностей.
Чем опасна трофическая язва — Википедия предупреждает!
Основным моментом в лечении трофических язв является выявление основного заболевания, вызвавшего язвенный дефект кожи. Такой подход обеспечит эффективное лечение язвы и предупреждение рецидивов. Опасность трофических язв заключается в том, что при отсутствии правильного лечения поврежденные клетки способны к злокачественному перерождению и появлению плоскоклеточного рака, в редких случаях саркомы кожи. Поэтому если даже ушла трофическая язва, лечение после операции должно продолжаться.
У вас трофическая язва? Лечение в Москве или в любом другом городе довольно длительное и представляет собой целый комплекс мер, чтобы исчезла трофическая язва. Лечение консервативное, то же, что и лечение медикаментозное направлено на уменьшение симптоматики основного заболевания, вызвавшего нарушение трофики тканей, лечение собственно язвенного поражения и борьбу с вторичной инфекцией.
Прекрасные результаты лечения трофической язвы лазером
В зависимости от стадии, по-разному убирается трофическая язва. Лечение (Москва предлагает множество методов) зависит от стадии развития трофической язвы и проводится по следующим направлениям:
Как быть, если у вас глубокие трофические язвы нижних конечностей? Что делать, если большая трофическая язва, лечение (фото, результаты вы уже оценивали) которой вы не проводили, увеличивается?
Трофическая язва — лечение в домашних условиях
О возможности лечения недуга в домашних условиях решает лечащий врач. С назначенным комплексом медикаментов пациент может делать перевязки дома, регулярно посещая при этом врача. Желательно, конечно, чтобы этот врач был хорошим специалистом в лечении трофических язв. В Москве таких докторов немного.
Ведущий специалист нашего центра по лечению трофических язв Малахов А.М.
В нашем центре «МИФЦ» этой проблемой занимается ведущий хирург-флеболог Малахов Алексей Михайлович.
Трофическая язва – лечение без операции
Если причиной язвенного дефекта не является венозная патология, то достаточно проведения консервативных мероприятий. Большим подспорьем в домашнем лечении начальных стадий язвенного поражения кожи при размере до 50 см 2 является портативный лазерный аппарат. Лазер, введенный в вену, способствует уменьшению вязкости крови, заметно снижается риск тромбообразования, усиливается кровоток в проблемных участках. Вдобавок лазерный луч эффективно снижает боль, уменьшается трофическая язва. Лечение лазером (отзывы есть ниже) в сочетании с консервативным лечением позволяет избежать хирургического вмешательства.
Лазеротерапию проводят курсами в 10-15 процедур. При правильном индивидуальном подборе параметров воздействия эта методика лечения не дает осложнений, пациенты отмечают хорошую переносимость процедур, устраняется быстро трофическая язва. Лечение лазером, цена которого не слишком высока, очень популярно.
Трофическая язва – лечение народными средствами
Если у вас трофическая язва, лечение народными средствами может только усугубить ситуацию. Лучше сразу записаться на прием к врачу, чтобы не стала глубже трофическая язва. Лечение (операция) – не так сложно, как может показаться. Об этом мы расскажем чуть ниже.
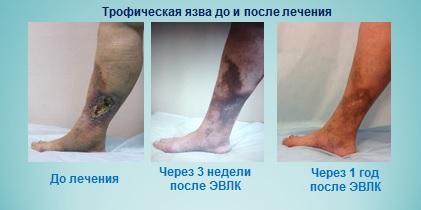
Трофическая язва — лечение лазером (ЭВЛО, ЭВЛК)
Более радикальный метод лечения трофической язвы — операция с применением лазерной коагуляции (Эндовазальная лазерная коагуляция). Методика ЭВЛК используется нами уже на протяжении многих лет. Данный метод лечения состоит в «выжигании» вены, которая находится в зоне трофической язвы. Результаты очень хорошие: язвы заживают практически на глазах. Рубцевание происходит в течение нескольких недель. При этом пациенты не выпадают из обычного режима жизни.
Лечение трофических язв лазером в центре «МИФЦ»
Лечение трофических язв лазером в Москве обладает рядом преимуществ:
Трофическая язва — лечение радиочастотой (РЧА, РЧО)
Радиочастотный метод лечения считается самым современным и безопасным, если у вас трофическая язва. Лечение РЧА в Москве заключается в нагреве микроволнами стенок вены, она «закрывается», потихоньку стягивается трофическая язва. Лечение РЧО – и спустя несколько месяцев проблемная вена представляет собой соединительно-тканный тяж, а вся нагрузка переходит на соседние, здоровые сосуды. Так постепенно заживает трофическая язва.
Лечение трофической язвы радиочастотой (РЧА, РЧО) в нашем центре
Лечение РЧО в Москве проводится достаточно быстро, через 10 минут после вмешательства пациент отправляется домой. Радиочастотный метод дает следующие преимущества:
Нужна ли при лечении трофической язвы диета
Чего надо избегать, если есть трофическая язва? Фото осложнений поможет вам держать себя в руках при диете. Питание при трофической язве исключает соленые продукты и пряности. Необходимо насытить организм питательными веществами, витаминами и Омега-3 кислотами. Особенно полезны овощи (морковь, помидоры, капуста), фрукты, орехи, молоко, сыры, растительное и сливочное масло, рыба. Питаться следует маленькими порциями, дабы избежать резкого повышения сахара в крови. Кардинального изменения рациона не требуется, небольшая его корректировка благоприятным образом скажется на процессе выздоровления.
Трофическая язва — профилактика
Чтобы не вернулась трофическая язва, лечение не прошло даром (стоимость которого можно узнать только после консультации), позаботьтесь о профилактике. Меры по предотвращению возникновения трофических язв и рецидивов:
Часто задаваемые вопросы наших пациентов в интернете о трофической язве
Как лечить незаживающие раны на ногах?
Чтобы эффективно лечить незаживающие раны на ногах, необходимо разобраться, как появились такие раны. Длительно незаживающие раны на ногах могут образовываться вследствие ряда совершенно различных патологий, и каждая требует своего, специфического лечения.
Чем лечить незаживающие раны в домашних условиях?
Прежде, чем начинать лечить длительно незаживающие раны в домашних условиях, нужно выяснить причину появления таких ран. Чаще всего это:
Если Вы хотите вылечить длительно незаживающие раны, то помимо местного использования мазей, необходимо заниматься основной патологией, вызвавшей проблему.
Чем обработать глубокую рану?
Чем обработать глубокую рану необходимо задать доктору на очной консультации. Лечить такие раны самостоятельно, с помощью интернета может быть чревато прогрессированием процесса и развитием жизнеугрожающего состояния.
У моего отца полгода назад появились болячки на ногах, как от них избавиться?
Если появились и длительно не проходят «болячки» на ногах, избавиться от них поможет, как правило, только врач. Длительно незаживающие раны, зачастую, признак серьёзной патологии, требующей специфического лечения.
Трофическая язва – лечение. Отзывы наших пациентов.
Отзыв пациента о лечении трофической язвы лазером в нашем центре.
Виктор Петрович, 65 лет.
Я пенсионер с целым возом всяких болячек. Ноги болели и опухали давно, но я, как и многие, откладывал поход ко врачу на потом. Принимал кое-какие таблетки по совету соседки-медсестры, хотя особенного улучшения и не замечал. В общем, дожился до того, что у меня на ноге появилась огромная язва. Дай Бог здоровья вашим врачам, я уже думал, что останусь без ноги. Сделали мне лечение лазером. Особенно в нюансы этого дела я не вникал, врачи гарантировали хороший результат. Все прошло без боли, буквально через несколько дней моя трофическая язва стала исчезать на глазах, и недели через две от нее остался лишь небольшой шрам. Конечно, были назначены разные лекарства, потом съездил в санаторий и забыл об этой страшной болезни. Спасибо всем докторам «Медицинского центра флебологии», особенно доктору Малахову Алексею Михайловичу.
Отзыв пациентки о лечении трофической язвы методом ЭВЛО в нашем центре.
Наша пациентка с хирургом-флебологом Малаховым А.М. после лечения
Постоянно ныла нога, было гудящее ощущение в ней в конце дня, а потом образовала трофическая язва, которая становилась все больше и больше. На операцию классическим способом не решалась, так как боялась после прочитанных в сети отзывов и всевозможных осложнений. Хорошо дочка в теме, нашла мне опытного доктора в Москве Малахова Алексея Михайловича. Перед операцией, а это эндовазальная лазерная коагуляция, в медцентре в Москве, где я решилась ее делать, сделали УЗИ сдала кровь и все. После операции заставили встать со стола и ходить около часа. Через 3 недели показалась моему врачу. О шрамах не беспокоилась, главное, чтобы язва быстрее зажила. Прошло 3 месяца после лазерной процедуры на ноге. Все прекрасно, язва стала совсем маленькой, но надеюсь, скоро совсем заживет.
Очень рада, что все прошло хорошо. Спасибо за все. Комиссарова Людмила Ивановна, 7 декабря 2016г.
ФЛЕГМОНЫ И АБСЦЕССЫ — современные возможности лечения
В чем трудность лечения флегмон и абсцессов? Почему нецелесообразно применять мази на вазелиново-ланолиновой основе? Какие местные препараты соответствуют современным представлениям о лечении флегмон и абсцессов? Несмотря на активное внедрение
В чем трудность лечения флегмон и абсцессов?
Почему нецелесообразно применять мази на вазелиново-ланолиновой основе?
Какие местные препараты соответствуют современным представлениям о лечении флегмон и абсцессов?
Несмотря на активное внедрение в клиническую практику новых групп антибиотиков, проблема профилактики и лечения гнойно-септических осложнений в хирургии по-прежнему актуальна. Так, согласно литературным данным, частота гнойно-воспалительных осложнений после грыжесечений достигает 28,3%, после резекций желудка — 28,4%, холецистэктомий — 32%, аппендэктомий — 40,4%, панкреатитов — 50% (Прискарь В. И., 1999).
Летальность при перитоните колеблется от 16 до 80% (Даценко Б. М. с соавт., 1998, Гельфанд Б. М. с соавт., 1999, Камзакова Н. И., 2000).
В структуре внутрибольничных инфекций послеоперационные инфекции составляют 12,2%, а постинъекционные инфекции — 17%. Необходимо отметить, что процент тяжелых последствий внутрибольничных инфекций практически одинаков для хирургических стационаров и амбулаторно-поликлинических учреждений — 15,2% и 15,6% соответственно.
Особую тревогу вызывают случаи запоздалой диагностики осложненного течения абсцессов или флегмон. Так, например, в зависимости от локализации первичного гнойного процесса могут формироваться тяжелые гнойные артриты (после внутрисуставного введения гормональных, обезболивающих препаратов), тромбофлебиты (после внутрисосудистого введения различных лекарственных средств) с последующей генерализацией инфекционного процесса, с формированием гнойных очагов во внутренних органах (в сердце, легких, почках).
Ретроспективный анализ тяжелых абсцессов и флегмон, осложнившихся сепсисом после длительного консервативного или недостаточно активного хирургического вмешательства, показывает, что одной из основных причин возникновения осложнений можно считать недостаточное внимание к ранней диагностике формирующихся абсцессов и флегмон различной локализации, предполагающей использование современных неинвазивных методов исследования (ультразвука, компьютерной томографии), а также инвазивных диагностических методов, и прежде всего диагностической пункции области инфильтрата. Особую тревогу вызывает так называемая выжидательная тактика, когда, выполнив диагностическую пункцию и удалив некоторое количество гноя, хирурги пытаются дренировать гнойную полость с помощью резиновой трубки и назначают какой-либо антибактериальный препарат.
Радикальные оперативные вмешательства на уже сформированном гнойном очаге выполняются слишком поздно, дренирование послеоперационной раны бывает, как правило, неадекватным.
Кроме того, не уделяется должного внимания проблеме асептики и антисептики при оказании помощи пострадавшим, а также при выполнении различных диагностических и лечебных манипуляций как на амбулаторно-поликлиническом, так и стационарном этапах лечения. Использование традиционных антисептиков в данных ситуациях, к сожалению, не предупреждает развитие инфекционного процесса, так как проблема устойчивости микроорганизмов в равной степени актуальна как для группы антибактериальных препаратов, так и для традиционных антисептиков.
К примеру, чувствительность S.aureus, E.coli, B.fragilis к раствору фурациллина составляет менее 3, 1 и 3% соответственно. Массивность контаминации P.aeruginosa в растворе фурациллина может достигать 106 КОЕ/мл. Частота контаминации раствора фурациллина грибами достигает 58%.
В табл. 1 приводится далеко не полный перечень традиционных препаратов, от которых необходимо отказаться полностью и которые, тем не менее, используются как в домашних условиях, так и в медицинских учреждениях.
В данном сообщении приводится анализ результатов лечения 166 больных с постинъекционными флегмонами и абсцессами в специализированном отделении ран и раневой инфекции Института хирургии им. А. В. Вишневского РАМН. Больных, как правило, переводили из других хирургических стационаров ввиду прогрессирующего нарастания клиники интоксикации, с полиорганной недостаточностью, с сепсисом.
Возраст пациентов колебался от 18 до 84 лет. 124 больных были в возрасте от 30 до 60 лет. Длительность лечения на предыдущем этапе от начала формирования гнойного процесса составляла от 12 суток до 1,5 месяцев.
Сопутствующие заболевания: гипертоническая болезнь — 46 больных, остеохондроз тазобедренных суставов — 31 пациент, пояснично-крестцовый радикулит — 27 больных, почечная колика — 16 и другие заболевания — 46.
Гнойно-воспалительные процессы возникали после введения обезболивающих препаратов (анальгина, баралгина), гипотензивных (папаверина с дибазолом, магнезии), гормональных препаратов, кордиамина, масляных растворов витаминов, кокарбоксилазы и др.
Инфекционный процесс в 139 случаях возникал после инъекций, выполненных медицинскими работниками (бригады «скорой помощи», процедурные и хирургические кабинеты поликлиник, стационары). В остальных 27 случаях препараты вводились в домашних условиях не медицинскими работниками. Локализация абсцессов: в подавляющем большинстве случаев — это места внутримышечных инъекций (ягодичные области, реже — предплечья и места паранефральных, паравертебральных блокад).
 |
| Рис. 1 |
При первичном обращении больного за помощью по месту жительства в случае появления первых признаков формирования воспалительного процесса в качестве препаратов первой помощи использовались 3%-ный раствор йода («йодная сетка»), компрессы со спиртом, мазью Вишневского, ихтиоловой мазью. Консервативное медикаментозное лечение с подключением физиотерапевтических методов иногда продолжалось до 2–3 недель (рис. 1).
В дальнейшем, уже в условиях хирургических стационаров после хирургического вмешательства, послеоперационные раны тампонировались либо марлевыми тампонами, пропитанными 10%-ным раствором хлорида натрия, мазью Вишневского, раствором фурациллина, либо с дренирующей целью в раны устанавливались перчаточные резинки или резиновые трубки.
Такой метод лечения быстро приводил к распространению гнойного процесса за пределы первичной локализации, нарастанию интоксикации, развитию сепсиса.
Ввиду неэффективности лечения после развития септического состояния больные переводились для дальнейшего лечения в специализированное отделение гнойной хирургии им. А. В. Вишневского.
При поступлении практически все больные сразу помещались в блок интенсивной терапии отделения гнойной хирургии, где они получали необходимую пред- и послеоперационную корригирующую медикаментозную терапию.
В Институте хирургии им. А. В. Вишневского РАМН разработан метод активного хирургического лечения гнойных ран, основанный на следующих принципах:
Использование вышеперечисленных дополнительных методов воздействия на раневую поверхность позволяет уменьшить обсемененность раневой поверхности патогенной флорой до уровня ниже «критического» — с 10 7-9 до 10 2-3 микробных тел в 1 г ткани раны.
Клинические примеры закрытия ран с помощью швов, дренирования и окончательный результат приведены на рис. 2, 3, 4.
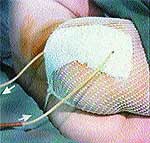 |
| Рис. 3 |
Во время поступления больного в отделение, а также в процессе лечения (во время перевязок, при повторных хирургических обработках ран, перед окончательным закрытием ран) проводятся бактериологические исследования видового состава ран. Результаты представлены в табл. 2.
Как видно из табл. 2, в подавляющем большинстве случаев из ран была выделена грамположительная микрофлора и в единичных случаях — ассоциация грамположительных и грамотрицательных микроорганизмов. Обращает на себя внимание достаточно большое число случаев выявления в ранах неклостридиальной анаэробной инфекции.
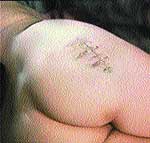 |
| Рис. 4 |
Все штаммы, выделенные из послеоперационных ран больных, ранее прооперированных в других лечебных учреждениях, были полирезистентны к традиционно используемым антибактериальным препаратам, что указывает на госпитальную принадлежность инфекции.
С учетом видового характера выделяемой из ран микрофлоры и чувствительности ее к антибактериальным препаратам назначались общая и местная антибактериальная терапии.
Наиболее часто (38,5%) использовались полусинтетические пенициллины (карбенициллин, ампиокс, диклоксациллин), в 15,7% случаев — аминогликозиды (гентамицин, тобрамицин, сизомицин, нетилмицин), в 12,5% — фторхинолоны (офлоксацин, пефлоксацин, ципрофлоксан), в 10,3% — цефалоспорины (цефотаксим, цефтазидим, цефтриаксон).
При обнаружении гнойно-воспалительного процесса, вызванного неклостридиальной анаэробной инфекцией (27 больных — 16,3%), как правило, назначалась комбинированная антибактериальная терапия — метронидазол с гентамицином или нетилмицином либо клиндамицин с гентамицином или нетилмицином. В последние годы в подобных ситуациях препаратом выбора считается имипенем, позволяющий активно воздействовать как на аэробный, так и анаэробный компонент микрофлоры ран. При локальном гнойном процессе, в случае выявления чувствительности стафилококков к фузидину, назначение этого препарата в комплексном лечении было также оправданно.
Выбор антисептиков, используемых для промывания ран
Как уже было сказано, использование раствора фурациллина в настоящее время нецелесообразно ввиду его крайне низкой антимикробной активности. В настоящее время перспективными можно считать растворы диоксидина, мирамистина, фурагина растворимого.
Прежде всего, очень важно следить за чистотой не только самой раны, но и окружающей рану кожи.
При выборе кожных антисептиков, используемых как с профилактической, так и лечебной целью, предпочтение отдается препаратам с универсальным, широким или умеренным спектром действия, активным против смешанной микрофлоры и обладающим микробоцидным или микробостатическим действием.
1%-ный йодовидон, 1%-ный йодопирон — йодофоры, представляющие собой комплекс поливинилпиролидона с йодом. Различия между этими препаратами связаны со способом их получения, а также разной молекулярной массой поливинилпиролидона. Растворы йодовидона более стабильны при хранении, чем растворы йодопирона, готовящиеся обычно ex tempore. По степени бактерицидного действия эти препараты практически идентичны.
Сульйодопирон представляет собой пенистую жидкость, которая предназначена для мытья грязных инфицированных ран, лечения ран под повязкой, обработки рук хирурга и операционного поля. Сульйодопирон при местном применении оказывает бактерицидное действие.
Бактерицидный эффект при микробной нагрузке 106-107 бактерий на 1 мл среды наступает в течение 1-4 минут, превосходя по этим показателям растворы йодопирона.
1%-ный диоксидин обладает выраженной активностью против большинства аэробных, анаэробных и факультативно анаэробных патогенных бактерий.
К диоксидину чувствительны клинические штаммы бактерий с полирезистентностью к антибиотикам. Препарат используется для промывания и тампонирования гнойных ран, а также может вводиться внутривенно, внутриартериально, интратрахеально через катетер или ингаляционно, внутриплеврально, в брюшную полость через ирригаторы.
Наш 20-летний опыт применения диоксидина в комплексном лечении больных с сепсисом, перитонитом, медиастинитом, с развернутой клиникой интоксикации, прогрессирующей полиорганной недостаточностью не подтверждает мнение некоторых специалистов о высокой токсичности этого препарата. Строгое соблюдение правил введения, разовых, суточных и курсовых доз позволяет избежать таких нежелательных побочных явлений, как тошнота, рвота или судороги.
0,1%-ный фурагин (солафур) — антимикробное средство из группы нитрофуранов. Препарат преимущественно действует на грамположительную микрофлору. Его МПК в 10-20 раз ниже, чем у фурациллина. Используется либо внутривенно при тяжелых формах течения раневой инфекции, при инфекционном процессе в легких, органах мочевыводящих путей, либо местно в виде 0,1%-ного раствора при лечении ран, инфицированных стафилококками, а также для промывания мочевого пузыря.
0,01%-ный мирамистин (миристамидопропилдиметилбензиламмоний хлорид) — новый антисептик из группы катионных ПАВ.
0,01%-ный водный раствор мирамистина с профилактической и лечебной целью используется в хирургии, травматологии и комбустиологии при незначительном количестве гнойного отделяемого в ране. Препаратом орошают поверхность ран и ожогов, рыхло тампонируют раны и свищевые ходы, марлевыми тампонами, смоченными антисептиком, промывают брюшную полость, вводят в плевральную полость и мочевой пузырь.
При обильной гнойной экссудации использование марлевых тампонов с растворами антисептиков для местного лечения ран неоправданно, так как тампоны, помещаемые в рану, быстро высыхают и, следовательно, не обладают необходимой для удаления гноя длительной осмотической активностью. В крайнем случае, рана может заполняться комбинированным тампоном — в центр марлевого тампона помещается силиконовая трубка, через которую 2-3 раза в сутки шприцем в рану вводится антисептик по 10-20 мл. Вместо 10%-ного раствора хлорида натрия для тампонирования послеоперационных ран в настоящее время используются современные мази на водорастворимой основе, высокую клиническую значимость которых можно считать доказанной.
Возможности использования мазей
К сожалению, до сих пор в ряде клиник используются мази на жировой основе с антибиотиками: линимент синтомицина, тетрациклиновая, эритромициновая и др. Однако мази на жировой основе с антибиотиками оказывают только кратковременное действие, поскольку вазелин-ланолиновая основа нарушает отток раневого отделяемого, не обеспечивает достаточного высвобождения активного ингредиента из композиции, не способствует проникновению антибиотика в глубь тканей, где находятся микробы, что приводит к переходу острых воспалительных заболеваний в хронические. Ввиду формирования в стационарах высокорезистентных штаммов микроорганизмов практически полностью утратили свою клиническую значимость и ихтиоловая мазь, и мазь Вишневского.
В последние годы в клиническую практику лечения гнойных ран в первой фазе раневого процесса внедрены новые мази — на полиэтиленоксидной основе (комбинации полиэтиленоксидов с молекулярным весом 400 и 1500).
Полиэтиленоксиды являются производными окиси этилена и обладают низкой токсичностью и выраженными осмотическими свойствами. При создании препаратов для лечения гнойных ран чаще всего используются полиэтиленоксид с молекулярным весом 400 (ПЭО-400) и полиэтиленоксид с молекулярным весом 1500 (ПЭО-1500).
В гнойной ране ПЭГ-1500 активно связывает воспалительный экссудат, отдавая его в повязку, с которой жидкость испаряется, а освободившиеся молекулы ПЭГ-1500 вновь присоединяют к себе экссудат, накапливающийся на дне раны.
Более мелкие молекулы (ПЭГ- 400) способны проникать в глубь тканей. Образуя с антибиотиком комплекс, ПЭГ-400 проводит его в ткани раны, где локализуются микробы. Этим он принципиально отличается от мазей на ланолин-вазелиновой основе, которые способны оказывать антимикробное действие только кратковременно и только на поверхности раны.
В состав современных мазей на полиэтиленоксидной основе введены различные антимикробные препараты:
Кроме того, в состав мазей введены такие препараты, как тримекаин, имеющий обезболивающий эффект, и метилурацил, обладающий анаболической и антикатаболической активностью, в целях стимуляции процессов клеточной регенерации.
Все мази на основе ПЭО отличаются от традиционных препаратов прежде всего многонаправленностью действия — осмотический эффект наблюдается до 18 часов, что позволяет делать перевязки только один раз в сутки, в то время как при использовании 10%-ного хлорида натрия повторные перевязки необходимо выполнять через каждые 3-4 часа, в противном случае повязка, пропитанная раствором и раневым отделяемым, полностью теряет осмотическую способность.
Еще одно преимущество мазей на полиэтиленоксидной основе — это широкий спектр антимикробной активности.
Причем по эффективности воздействия в силу однотипности мазевой основы все мази практически равноценны. При создании новых мазей особое внимание уделялось их антибактериальной активности. А. В. Вишневский по этому поводу писал: «Мы интересуемся силой, степенью бактерицидных свойств мази, ибо снизить, сбить, уничтожить инфекцию в ране всегда является задачей необходимой и благодарной» (Вишневский А. В., 1937).
Антимикробная активность новых мазей в отношении S.aureus находится на уровне 86-97,3%, Е. coil — 71-97%, Р.aeruginosa — 64-90,8%, Proteus spp. — 76-100%.
Для подавления в ранах грамотрицательных бактерий, в частности синегнойной палочки, широко применяется 10%-ная мазь мафенида-ацетата на гидрофильной основе.
Несмотря на интенсивное применение мазей, содержащих левомицетин или диоксидин, их высокая антимикробная активность сохраняется на протяжении более 20 лет, что указывает на слабый процесс нарастания резистентности госпитальных штаммов.
С внедрением полиэтиленгликолевой основы в технологию создания новых лекарственных форм появилась возможность создать мази с нитрофурановыми соединениями. На их основе выпускаются две мази: 0,5%-ная мазь хинифурила, а также фурагель, где в качестве основы использован сополимер акриловой кислоты (СОКАП) и ПЭГ-400.
Новые отечественные мази, содержащие нитрофурановые соединения, показывают высокую клиническую и бактериологическую эффективность. Так, фурагель более активен (94%) при наличии в ране S.aureus и менее активен (79%) при Р.aeruginosa. Maзь хинифурила одинаково высоко активна при наличии в ране грамположительной и грамотрицательной микрофлоры (87-88%). Оба препарата хорошо переносятся даже в случае их длительного использования при лечении трофических язв. Применение сополимера акриловой кислоты с полиэтиленгликолем в различных весовых соотношениях в качестве мазевой основы позволяет регулировать осмотическую активность мази как в сторону ее повышения, так и снижения, что очень важно при переходе раневого процесса во вторую фазу и необходимости продолжения лечения раны под повязкой.
Клиническая эффективность 1%-ной йодопироновой мази и многокомпонентной йодсодержащей мази (йодметриксилена) в качестве лечебного средства составляет 92,6-93,4%. Бактериологическая активность этих двух препаратов была одинаково высокой (91,8-92,6%) в отношении всех основных возбудителей острых гнойных процессов мягких тканей. Побочные эффекты (клинически значимые) наблюдались в 0,7% случаев и клинически незначимые — в 2,3% случаев. Следует особо подчеркнуть высокую эффективность этих препаратов при лечении ран с грибковым поражением, что часто наблюдается у больных ослабленных, с обширными ожоговыми ранами, трофическими язвами, пролежнями.
В настоящее время в клиническую практику внедрены только зарубежные йодсодержащие мази (повидон-йод и бетадин), хотя отечественный аналог был разработан более десяти лет назад.
Установлено, что уровень обсемененности ран аэробной микрофлорой при лечении мазями на ПЭГ-основе опускается «ниже критического» к 3-5-м суткам. Появление грануляций в среднем достигается к 4-м суткам, начало эпителизации — к 5-м.
Широкий спектр антимикробной активности мазей на полиэтиленгликолевой основе, их высокая и длительная осмотическая активность позволяют более чем в 80% случаев в течение 4-5 суток купировать острый гнойный процесс и закончить лечение неосложненных гнойных ран мягких тканей наложением первично-отсроченных швов, тогда как при использовании гипертонического раствора хлорида натрия в 90% случаев только в конце 2-3-й недели лечения под прикрытием системной антибактериальной терапии удается закрыть рану путем наложения вторичных швов.
Для лечения неспорогенной анаэробной инфекции наряду с диоксидином перспективные возможности открылись после изучения препарата нитазола, показавшего высокое антибактериальное действие на стафилококки, стрептококки, кишечную палочку, аэробные спорообразующие бактерии, патогенные анаэробные микроорганизмы как клостридиальные, так и неклостридиальные в виде монокультур и микробных ассоциаций. По спектру антибактериального действия нитазол имеет преимущества перед метронидазолом, к которому нечувствительны стафилококки, кишечная палочка, стрептококки. Нитазол оказывает противовоспалительное действие, являясь нестероидным противовоспалительным средством.
На основе нитазола были созданы пенообразующий аэрозоль «Нитазол» и две многокомпонентные мази «Стрептонитол» и «Нитацид». По антимикробной активности стрептонитол и нитацид значительно превосходят зарубежный препарат «Клион» (Венгрия), в состав которого входит метронидазол. Осмотическая активность стрептонитола гораздо ниже, чем у нитацида, что обусловлено введением в его состав вазелинового масла с водой. И стрептонитол, и нитацид, созданные для лечения ран с неклостридиальной анаэробной инфекцией, обладают равнозначным широким спектром антимикробной активности как в отношении грамположительной, так и грамотрицательной микрофлоры (84,2-88,5%). Обращает на себя внимание высокая активность этих препаратов при наличии в ране Р.aeruginosa (86,3-91,1%). Обе позиции показывают хорошую клиническую эффективность при наличии в ране анаэробной инфекции (88-89%).
Различие в осмотической активности позволяет использовать эти препараты ступенчато — сначала нитацид (с высокой осмотической активностью), затем стрептонитол.
Специалисты, занимающиеся лечением гнойных ран, хорошо знают, что бывают ситуации, когда одного скальпеля для полного удаления некротических тканей недостаточно: необходимы протеолитические препараты.
В настоящее время доказана высокая клиническая эффективность комплексного ферментного препарата «Протогентин», содержащего фермент природного происхождения «протеаза С» с протеолитическим действием, антибиотики (гентамицин и эритромицин), консерванты.
Мазевая основа препарата состоит из полиэтиленоксида с вазелиновым маслом. Умеренная осмотическая активность обеспечивает удаление из раны гноя.
Протогентин, наиболее активный в отношении P.aeruginosa и Е.coli, подавляет рост 83,4-90,4% штаммов.
Антимикробные компоненты мази «Протогентин» хорошо проникают под струп раны, вследствие чего в тканях раны создаются концентрации, намного превышающие МПК.
Достаточная осмотическая активность, широкий спектр антимикробной активности, хорошие фармакокинетические свойства протогентина способствуют сокращению сроков некролизиса. Мазевая основа не повреждает грануляционную ткань, что позволяет использовать этот препарат в течение длительного времени, пока требуется ферментативная очистка раневой поверхности.
После очищения раны от гнойно-некротического содержимого и достижения ее бактериологической санации наступает вторая фаза раневого процесса. Этот период характеризуется появлением в ране островков грануляционной ткани, которая, развиваясь, покрывает раневую поверхность полностью. Здоровая грануляционная ткань всегда яркая, сочная, легко кровоточит. При малейшем ухудшении процессов биосинтеза в ране изменяется внешний вид грануляций: они теряют яркую окраску, становятся мелкими, покрываются слизистым налетом. Одной из причин такого осложнения считается суперинфекция. Всякое замедление развития грануляций ведет к задержке и остановке процесса эпителизации.
Большое значение для скорейшего заживления ран во второй фазе имеет способность препаратов, используемых для местного лечения, оказывать бактерицидное действие в целях предупреждения вторичной инфекции, защитить грануляционную ткань от механических повреждений, а также оказывать умеренное влагопоглощающее действие и стимулировать рост грануляций.
Оптимальный вариант — сочетание этих факторов в одном препарате. К таким препаратам относятся современные комбинированные мази на регулируемой осмотической основе: метилдиоксилин, стрептонитол, а также пенные аэрозоли «Cульйодовизоль», «Гипозоль-АН», раневые покрытия на основе натриево-кальциевой соли альгиновой кислоты, масла, аэрозоли, гидроколлоидные покрытия (табл. 3).
Мазь «Метилдиоксилин» — многокомпонентная мазь, содержит диоксидин, метилурацил и гидрофобную эмульсионную основу с наличием касторового масла. Композиция винилина с эмульгатором и ПЭГ-400 в качестве основы мази позволила снизить осмотическую активность этого препарата до такого уровня, чтобы новая мазь не пересушивала молодую грануляционную ткань.
Мазь «Стрептонитол» содержит антибактериальные вещества стрептоцид и нитазол на гидрофильной эмульсионной основе, которая оказывает слабое осмотическое действие, удаляя избыток влаги, и одновременно защищает грануляционную ткань от механических повреждений. Препарат показан для лечения во второй фазе воспаления ранее инфицированных анаэробной, грамположительной и грамотрицательной микрофлорой ран при наличии ярких сочных грануляций.
Аэрозоли
На переходном этапе первой фазы раневого процесса во вторую высокую клиническую эффективность показывают современные пено- и пленкообразующие аэрозоли. Пенные препараты в аэрозольной упаковке перспективны для профилактики и лечения гнойных осложнений. Это обусловлено тем, что пены создают барьер для инфицирования ран, они не обладают «парниковым эффектом»; небольшим количеством препарата в составе пены можно покрывать большие по площади раневые поверхности и заполнять объемные раневые каналы и «карманы». Преимуществом аэрозольной формы является быстрота обработки, что важно при массовом поступлении пострадавших. Аппликации пен атравматичны.
В настоящее время создан ряд пенных препаратов:
В состав современных пенных препаратов обязательно входит какое-нибудь антимикробное средство, действующее на аэробную или на анаэробную микрофлору, включая неклостридиальную (бактероиды, пептококки, пептострептококки). Чаще всего используются диоксидин, йодовидон, циминаль и нитазол. Исследования антибактериальных свойств этих препаратов на моделях гнойных ран, вызванных анаэробной инфекцией, показывают выраженный терапевтический эффект, заключающийся в снижении высеваемости бактерий из ран к 3-5-му дню лечения до 10 1-2 микробов на 1 г ткани, уменьшении отечности и гиперемии, прекращении гнойной экссудации и в дальнейшем в заживлении ран.
Цимезоль кроме антисептика циминаля содержит анестетик тримекаин и гемостатик — порошок окисленной целлюлозы. Антисептическое действие циминаля усиливается благодаря сочетанию с димексидом и 1,2-пропилен-гликолем, которые обеспечивают проникновение циминаля в зоны некрозов и умеренный осмотический эффект.
Диоксизоль приготовлен на высокоосмотичной основе, а дегидратирующее действие диоксипласта сведено до минимума. Это определяет их применение соответственно в первой и во второй фазах раневого процесса при отсутствии в ранах большого количества гнойного отделяемого. Изучение антимикробной активности нового аэрозоля-диоксизоля показало преимущество этого препарата в случае выявления в ранах грамотрицательной микрофлоры. Диоксизоль подавляет Ps.aeruginosa в 92,5%.
Сульйодовизоль — пенообразующий аэрозольный препарат, расширяет возможности лечения ран йодовидоном в хирургии. Препарат показан для лечения ран во второй фазе раневого процесса, ранее инфицированных грамположительной и грамотрицательной аэробной микрофлорой.
Широкие клинические исследования показали необходимость использования пенообразующих аэрозолей только при отсутствии выраженного гнойно-воспалительного процесса на этапах подготовки раны к ее закрытию швами или методом пластики.
Масла
В настоящее время для лечения ран широко используются различные масла, в том числе и растительного происхождения (масло облепихи, масло шиповника, просяное масло — милиацил). Первые публикации о применении с этой целью различных масел относятся к эпохе Возрождения (Джованни де Виго, 1460-1520, Ambroslse Pare, 1510-1590).
Сравнительные экспериментальные исследования показали, что просяное масло прежде всего обладает более широким антимикробным спектром действия по сравнению с маслом шиповника или облепихи.
Просяное масло (милиацил) имеет высокое кислотное число (151,5-178,3), обусловленное большим содержанием свободных, ненасыщенных жирных кислот (олеиновой, линолевой, линоленовой). Этим объясняются стерильность препарата и его достаточный антимикробный эффект. Кроме того, входящее в состав просяного масла сложное стероидное соединение — пентациклический тритерпеноид — милиацин — обладает анаболическим действием и является стабилизатором мембран. Стабилизируя лизосомальные мембраны, милиацин предохраняет их от действия мембраноповреждающих факторов, например токсинов. В связи с этим уменьшается активность катепсинов, кислых РНК-азы и ДНК-азы, что приводит к уменьшению экссудации ткани, гипоксии, деполяризации РНК и ДНК.
Раневые покрытия
Широкие возможности в местном медикаментозном лечении ран открылись с появлением различных раневых покрытий, обладающих такими ценными качествами, как антимикробная активность, способность надежно предупреждать реинфицирование раневой поверхности, способность обеспечивать локальный гемостаз, ускорять образование грануляций, эпидермиса и активно поглощать раневой экссудат. Кроме того, современные раневые покрытия активно стимулируют образование грануляций и эпидермиса. При смене повязок эти препараты не вызывают болезненных ощущений. При длительном нахождении раневых покрытий на ране не возникает неприятного запаха.
В целях стимуляции процессов регенерации в ране наиболее широко используются перевязочные средства на основе производных белков и полисахаридов. С учетом специфического воздействия коллагеновых соединений на репаративные процессы в ране, а также данных по эффективности полисахаридных соединений с позиций создания оптимальных условий для формирования грануляционной ткани и миграции эпителиальных клеток разработаны раневые покрытия на основе белково-полисахаридных комплексов и их композиций с лекарственными препаратами. В качестве полисахаридных соединений использованы растительный полисахарид (альгинат натрия) и полисахарид животного происхождения (хитозан).
Биологически активные стимулирующие раневые покрытия
Биологически активные стимулирующие раневые покрытия с антимикробным и местно-анестезирующим действием выпускаются в четырех вариантах:
Перечисленные раневые покрытия благотворно влияют на течение регенераторных процессов в ране. Коллаген-альгинатные покрытия стимулируют рост грануляционной ткани, а коллаген-хитозановые — рост эпителиальных клеток.
В последние годы наибольшее распространение получили препараты на основе альгиновой кислоты и коллагена.
На основе смешанного натриево-кальциевой альгиновой кислоты созданы полифункциональные влагопоглощающие препараты для местного лечения ран во второй фазе (альгипор, альгимаф).
Стимулирующие раневые покрытия хорошо моделируются на различных участках тела, обеспечивают нормальный парообмен в ране, сорбируют избыток раневого экссудата, обладают пролонгированным антимикробным и обезболивающим действием, создают влажную среду, оптимальную для миграции эпителиальных клеток. Выход лекарственных средств из стимулирующих раневых покрытий осуществляется в течение 48-72 часов в зависимости от количества раневого экссудата в ране.
Все современные раневые покрытия обладают высокой антимикробной активностью за счет введенных в них противомикробных компонентов (сизомицин — в сипролине, мафенид-ацетат — в альгимафе, фурагин — в альгиколе АКФ и коллахите ФА).
Сравнительная оценка антибактериальной активности этих препаратов показывает, что элиминация S.aureus, Proteus spp. из ран быстрее происходит при использовании альгимафа и сипролина.
Гидроколлоиды
В последние годы за рубежом для лечения больных с длительно незаживающими ранами, трофическими язвами, пролежнями нашли применение гидроколлоидные лекарственные средства, в частности содержащие пектин — дуодерм (США), варигесив (США).
В НПО «Биотехнология» (Россия) совместно с Институтом хирургии им. А. В. Вишневского РАМН разработаны две гидроколлоидные лекарственные формы нового поколения на основе пектина: галактон — жидкий гидроколлоид, предназначенный для лечения длительно незаживающих глубоких ран мягких тканей с умеренным количеством гнойного отделяемого; галагран — сухой гидроколлоид (порошок) для лечения поверхностных ран мягких тканей, пролежней, трофических язв.
За счет введенного в состав диоксидина гидроколлоиды показывают лучшую активность по сравнению с другими препаратами в отношении P.auruginosa.
При сравнении гидроколлоидов (галаграна и галактона) с сорбентами (дежизаном и дебризаном) выявляется более широкий спектр положительных свойств гидроколлоидов. Прежде всего, гидроколлоиды стимулируют процессы регенерации и эпителизации, предупреждают реинфицирование раневой поверхности, поддерживают влажную среду под повязкой. Показатель сорбционной способности галаграна невысок: по воде — 3,56 г/г, по крови — 2,57 г/г; при этом верхний слой галаграна не смачивается модельными жидкостями на протяжении всего срока наблюдения (одни сутки).
Основное поглощение воды идет в течение 5 часов, далее наблюдается снижение количества сорбированной жидкости за счет подсыхания верхнего слоя и образования корочки, затрудняющей процесс дренирования. Частицы галаграна в контактном слое набухают, превращаясь в гелеобразную массу, которая равномерно растекается по ране.
По данным цитологического исследования, в первые трое суток использования галаграна в раневых отпечатках выявляется тенденция интенсивного формирования грануляционной ткани.
Учитывая природу биополимера, гидроколлоиды (галагран и галактон) целесообразно применять на стадии развития в ране репаративных процессов.
Гентацикол
Высокоэффективным препаратом для лечения длительно незаживающих ран, трофических язв, остеомиелита, диабетической стопы является препарат гентацикол — пролонгированная форма гентамицина на биодеградируемой (коллагеновой) основе.
Содержание антибиотика в биоптатах ран, получаемых от больных различных клинических групп, зависит от количества раневого отделяемого и скорости рассасывания коллагеновой основы.
Длительные и высокие концентрации гентамицина обнаруживаются при использовании гентацикола в лечении остеомиелита или в случаях окончательного закрытия швами остеомиелитической полости.
Гентацикол создает высокие концентрации гентамицина в тканях раны на протяжении 2 недель, причем эти концентрации намного превышают МПК основных возбудителей хирургической инфекции.
Биодеградируемая коллагеновая губка с гентамицином способствует купированию инфекционного процесса, активизирует пролиферацию всех клеточных элементов грануляционной ткани, усиливает коллагеногенез. Препарат может использоваться в ургентной хирургии в качестве местного гемостатика. Использование гентацикола в комплексном лечении различных ран позволяет сократить показания к проведению общей антибактериальной терапии с 16,6 до 5,5%; при этом в 98,2% случаев ранние реконструктивно-восстановительные кожно-пластические операции оказываются успешными.