синцитиальные почки что это
Трофобластическая болезнь
Трофобластическая болезнь — опухолевое новообразование, развивающееся на фоне прерванной или текущей беременности.
Трофобласт — это внешний слой оболочки зародыша. Именно в этих тканях развивается злокачественная опухоль, которая характеризуется нарушением развития и роста трофобласта.
Причины трофобластической болезни
Основной фактор риска постановки диагноза «трофобластическая болезнь» — поздняя беременность. На фоне развития беременности в возрасте старше 35 лет у женщин повышается риск развития опухолевого процесса в трофобласте.
Так же прерванная беременность в полном объеме или частично является причиной возникновения заболевания. Трофобластическая болезнь проявляется чаще всего при нескольких абортах в репродуктивном возрасте женщины.
Трофобластическая болезнь возникает у женщин, которые выносили несколько беременностей. Также нарушение менструального цикла и длительного приема оральных контрацептивов является причиной возникновения данного недуга.
Виды трофобластической болезни
Трофобластическая болезнь обладает различным злокачественным потенциалом.
Гистологическая классификация:
Комбинация из всех типов проявления болезни называется гестационной трофобластической болезнью.
Пузырный занос
Данный вид патологии заключается в аномальном развитии трофобласта в виде пузырьков. Пузырьковый занос бывает полным и частичным.
При полном пузырном заносе происходит атипичное изменение трофобласта. Ворсинки хориона не имеют сосудов, и при обследовании невозможно определить эмбрион. Аномальная ткань трофобласта имеет генетический набор из сперматозойдов отца.
Трофобластическая болезнь проявляющаяся в виде частичного пузырного заноса. Атипичность клеток носит ограниченный локализованный характер. Генетический набор включает нормальную яйцеклетку и два спермия.
Проявление симптомов пузырного заноса происходит на ранней стадии беременности, что позволяет сразу начать лечение. Коварное заболевание проявляется симптомами замершей беременности, то есть увеличением матки, высоким уровнем ХГЧ и влагалищным кровотечением.
Гестационный тип недуга чаще всего вызывает самостоятельное прерывание беременности. Если этого не произошло, то лечение пузырного заноса эффективно с помощью удаления атипичных тканей или части матки. После эффективного лечения женщина может планировать беременность в будущем. Не лечение данного проявления может вызвать гестационную трофобластическую болезнь.
Инвазивный пузырный занос
При инвазивном пузырном заносе происходит прорастание аномальных клеток в миометрий.
Симптомы заболевания характеризуются кровотечением и болью в нижней части живота.
Хориокарцинома
Причинами возникновения злокачественного развития трофобласта является пузырный занос, аборт, нормальная или внематочная беременность.
Опухоль быстро развивается и внедряется в ткани миометрия и активно размножаются. Трофобластическая болезнь с такой формой развития метастазирует в любые ткани и легкие.
Стадийность заболевания такая же, как и у пузырного заноса.
Проявление симптомов хориокарциномы выражено кровянистыми выделениями темно-коричневого цвета, не зависящими от менструации, грубостью груди, увеличением матки, нарушением гормонального фона.
Лечение заключается в курсах химиотерапии и хирургическом вмешательстве.
Синцитиальный эндометрит
Данный вид трофобластической болезни имеет доброкачественный характер. Установить диагноз можно с помощью гистологического исследования соскобов ткани со стенок матки. Лечение ограничивается выскабливанием слизистых тканей.
Симптомы трофобластической болезни
Трофобластическая болезнь наиболее часто проявляется в виде кровотечения в первом триместре беременности. Частые симптомы трофобластической болезни выражены кровотечениями, болями внизу живота, и увеличенным размером матки.
Важным симптомом заболевания являются также кровянистые выделения, но с примесями серозной и гнойной жидкости. Наблюдения выделений могут возникнуть и после беременности. Симптомы обусловлены разрывами сосудов около опухоли.
Трофобластическая болезнь при метастазировании в ближайшие органы может проявиться внутрибрюшным кровотечением. При таком течении заболевания возможны сильные схваткообразные боли в области живота. Также у пациенток может наблюдаться повышенная температура тела. Трофобластическая болезнь вызывает симптомы в виде увеличения молочных желез и выделения молозива.
Метастазы в органы характеризуются проявлением симптомов в зависимости от расположения опухолевого процесса. Опухоль в легких — кашель и боль в грудной клетке; в ЖКТ — рвота, тошнота, диарея; головной мозг — боли, тошнота, нервные расстройства.
К основной симптоматике трофобластической болезни относится быстрая утомляемость, нарушение сна, снижение аппетита, потеря веса. Трофобластическая болезнь негативно сказывается на эмоциональном состоянии женщины, так как непосредственно связана с возможной или уже наступившей беременностью.
Диагностика трофобластической болезни
Трофобластическая болезнь устанавливается на клинических признаках. Выраженная симптоматика заболевания позволяет выявить болезнь, но уже на поздних этапах развития опухоли, что повышает риск метастазирования и неэффективности лечения.
Установить диагноз «трофобластическая болезнь» возможно из нескольких заключений, основанных на физикальном обследовании, анализе крови и мочи, гистологии тканей матки, рентгенологическом исследовании и результата показателей уровня ХГЧ.
При первичном обследовании у врача акушера-гинеколога собирается общий и семейный анамнез. Беседа позволяет вычислить похожие симптомы и определить риск возникновения трофобластической болезни. После проведения физикального обследования можно выяснить картину недуга и назначить необходимые исследования. Также во время осмотра берется соскоб со стенок матки для гистологии и постановки точного диагноза.
Гистология не всегда может выявить заболевание, поэтому для определения трофобластической болезни назначается анализ для выявления уровня хорионического гонадотропина человека.
Рентгенография и компьютерная диагностика позволяет определить наличие метастазов трофобластической болезни в другие органы.
Гестационная трофобластическая болезнь
Гестационная трофобластическая болезнь — это совокупность патологический проявлений опухолевого процесса в трофобласте. Гестационная трофобластическая болезнь возникает из оплодотворения яйцеклетки аномальными сперматозойдами. Она включает в себя: инвазивный пузырный занос, хориокарцинома и трофобластическую болезнь эпителия и плацентарного ложе.
Развитие опухолевого процесса разделяется на четыре этапа:
Лечение гестационного проявления трофобластической опухоли назначается в виде химиотерапии. Гестационная трофобластическая болезнь крайне чувствительна к лекарственному лечению. В основном применяется только один терапевтический препарат, но при запущенности заболевания до 4 стадии возможно применение комбинаций.
Лечение трофобластической болезни
Лечение назначается в комбинации из химиотерапии, лучевой терапии и оперативного вмешательства.
Противоопухолевая терапия включает прием и вливания лекарственных препаратов. Лечение гестационного типа заболевания происходит несколькими курсами с прерываниями на несколько недель. После снятия клинических проявлений назначается два профилактических курса, а после лечения рекомендуется наблюдение у врача гинеколога-акушера в течении двух лет.
Оперативное вмешательство назначается при больших размерах опухоли и сильной симптоматике. Неэффективность химиотерапевтического лечения, обильные кровотечения и высокий болевой синдром является показанием к удалению опухоли вместе с маткой или частично с пораженными участками.
Лучевая терапия применяется для снятия признаков заболевания и снижению рисков метастазирования в другие органы. Прием лучевых доз назначается дистанционно или внутриполостным способ через влагалище. Лечение происходит дозированно в несколько курсов.
Филиалы и отделения, в которых лечат трофобластическую болезнь
МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России.
Гинекологическое отделение
Заведующая – д.м.н, МУХТАРУЛИНА Светлана Валерьевна
МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России.
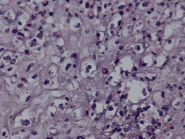
Синцитиальные почки что это
Морфологическое исследование плаценты закономерно считается важным этапом при анализе причин развития осложнений беременности и родов [5]. В первую очередь, это касается наблюдений задержки роста и гибели плода, отслойки плаценты, преждевременных родов, преэклампсии [8]. В этой связи важным направлением исследований является выявление морфологических диагностических критериев плацентарной недостаточности вообще и поражений структур плаценты в частности.
Цель работы: определение диагностической значимости синцитиальных узелков в ворсинах плаценты при ранней и поздней преэклампсии.
Материалы и методы исследования
В основу работы положен комплексный морфологический анализ 150 последов. Первую группу составили последы от 26 пациенток, течение беременности у которых осложнилось развитием ранней (до 34 недель беременности) преэклампсии. Вторую группу – последы от 84 беременных с поздней (после 34 недель беременности) преэклампсией. Контрольные группы (ранней и поздней) составили соответственно 12 и 28 пациенток с физиологическим течением беременности и не имевших экстрагенитальной патологии. Критериями включения послужили одноплодная беременность, преэклампсия, соответствующая критериям МКБ-10, и согласие женщины на проведение исследования. Критериями исключения были многоплодная беременность, тяжелая соматическая патология, а также генетические пороки развития плода.
Макроскопическое изучение последов и взятие кусочков для гистологического исследования проводили в соответствии с общепринятыми рекомендациями [1; 2]. Фрагменты ткани плаценты фиксировали в 10%-ном нейтральном формалине. Гистологическое исследование проводили на парафиновых срезах, окрашенных гематоксилином и эозином. Выраженность синцитиальных узелков оценивали по их количеству в терминальных ворсинах в поле зрения микроскопа (объектив х20). Они расценивались как слабо выраженные при выявлении их в 3 и менее ворсинах, умеренно выраженные – в 4-6 ворсинах и выраженные – в 7 и более терминальных ворсинах.
Статистическую обработку данных проводили с использованием программы «Statistica 8» путем расчета критерия хи-квадрат с поправкой Йетса и точного критерия Фишера, а также показателей чувствительности, специфичности и диагностической точности.
Результаты исследования и обсуждение
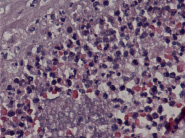
Примечательно, что синцитиальные узелки выявлялись во всех исследованных нами плацентах, но степень их выраженности отличалась. Так, у пациенток, страдающих ранней преэклампсией (рис. 1), отмечалось значимое преобладание (в 65,4% наблюдений) умеренного количества синцитиальных почек в терминальных ворсинах по сравнению с группой раннего контроля (p 0,05). В последней отмечалось статистически значимое преобладание (в 78,6% наблюдений) умеренно выраженных изменений по сравнению с группой поздней преэклампсии (p
Опыт исследования развития фетоплацентарной недостаточности при герпесвирусной инфекции
Ташкентский институт усовершенствования врачей, Узбекистан
Внутриутробная инфекция (ВУИ) представляет собой серьезную проблему современной перинатальной медицины, так как данное осложнение может быть причиной перинатальной патологии и смертности матери и ребенка [1-3, 6, 9].
ВУИ играет важную роль в генезе различных патологических процессов при беременности, оказывает вредное влияние на исход беременности и состояние новорожденного. В подавляющем большинстве случаев ВУИ является причиной антенатальной патологии: 32% самопроизвольного выкидыша, 24% внутриутробной задержки развития плода и преждевременных родов. Наиболее распространенным представителем нативных вирусов является герпесвирусная инфекция, частота обнаружения вируса простого герпеса (ВПГ) составляет 98,9% среди взрослого населения земного шара [1, 2, 4, 7].
В последние годы отмечается тенденция к увеличению инфицирования беременных ВПГ. Генитальной герпетической инфекции уделяется большое внимание, так как ее способность активно размножаться в плаценте и эмбриональных тканях, проникать через плацентарный барьер и вызывать внутриутробное поражение плода приводит к формированию плацентарной недостаточности и развитию пороков развития плода [1-3, 6].
Возрастающая роль внутриутробных инфекций среди причин неблагоприятных перинатальных исходов определяет актуальность всестороннего изучения этой проблемы.
Цель исследования: изучение роли ВПГ в генезе плацентарной недостаточности и определение специфических изменений в плаценте женщин с генитальной герпетической инфекцией.
Материалы и методы исследования. Под нашим наблюдением находилось 204 женщины с диагностированной вирусной инфекцией, Возраст больных составлял от 18 до 37 лет. У всех пациенток в анамнезе (1,2±0,4 года назад) были перинатальные потери, хронические воспалительные заболевания репродуктивной системы, что и послужило основанием для проведения детального клинико-лабораторного, в том числе серологического, обследования на наличие вирусной инфекции. Также проводилось ультразвуковое исследование плода и плаценты в 16-17, 24-28 недель гестации и накануне родов с осуществлением допплерометрии и ультразвуковой фетометрии плода.
Макроскопическое, морфометрическое, гистологическое и иммуногистохимическое исследование плаценты, пуповины и околоплодных оболочек.
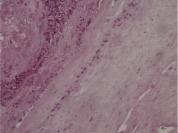
Во всех наблюдениях при наличии доношенной беременности в плаценте отмечались различной степени выраженности нарушения дифференцировки структур. При этом выявлялись поля ворсин, находящихся на разных стадиях развитая. Преобладали терминальные ворсины. Наряду с ними определялись участки, содержащие незрелые и зрелые промежуточные, хаотичные, склерозироваиные и единичные эмбриональные ворсины. Незрелые промежуточные ворсины характеризуются неправильной формой, крупными размерами (диаметр 110-180 мкм), единичными отходящими от них мелкими ветвями, рыхлой стромой, слабой васкуляризацией (5-8 центрально расположенных мелких капилляров), присутствием клеток Кащенко-Гофбауэра. Наличие значительного количества таких ворсин в плаценте при доношенной беременности свидетельствует о нарушении развития ворсинчатого хориона при сроке гестации 19-25 недель. Зрелые промежуточные ворсины имеют округлую форму, диаметр 60-80 мкм, малое количество ответвлений. В рыхлой строме центрально и субэпителиально видны 5-6, иногда 6-8 гиперемированных капилляров. Доминирование таких ворсин характерно для 26-31 недель беременности. Во всех случаях наблюдаются в различном количестве эмбриональные ворсины. Крупные (диаметром 120-140 мкм), многопластные, бессосудистые, покрытые тонким синцитиотрофобластом, они имеют рыхлую строму, систему стромальных каналов и свободно лежащие клетки Кашенко-Гофбауэра. Преобладание таких ворсин характерно для 8-12 нед. гестации. Таким образом, во всех наблюдениях отмечалось диссоциированное развитие ворсинчатого хориона с преобладанием терминальных ворсин.
Рис. 1. Патологическая незрелость ворсин хориона при герпесвирусной инфекции у беременных
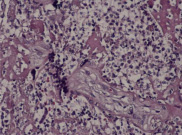
В ткани плаценты с помощью флюоресцирующих моноклональных антител выявлялись антигены вируса простого герпеса 1-го и 2-го типа. Причем 1-й тип у 15%, 2-й у 40%, сочетание 1-го и 2-го типов у 45%. Светооптически в плаценте пораженных только вирусом простого герпеса 1-го или 2-го типа, изменения идентичны. Характерным является наличие ограниченного продуктивного очагового воспаления с вовлечением в патологический процесс плодовой и материнской частей плаценты. При этом в эпителии амниона, синцитиотрофобласте, эндотелии сосудов, клетках базальной пластинки и септ выявляются гигантские одноядерные клетки с крупными гиперхромными ядрами, содержащими базофильное включение. Последние отделены от кариолеммы полоской просветления и содержат антиген вируса простого герпеса. Часть клеток эпителия амниона и трофобласта претерпевает некротические изменения. Во всех случаях наблюдаются распространенные поражения стенок сосудов ворсин в виде очагового эндоваскулита, иногда с некрозом части внутренней выстилки и формированием тромбов. Интервиллезит встречается нечасто и носит очаговый характер. Более типичными являются кровоизлияния или очаги тромбоза в межворсинчатом пространстве. Базальный децидуит различной степени выраженности имеется во всех наблюдениях. Некротические изменения встречаются как в отдельных клетках, так и в виде очагов. Постоянно выявляются участки склероза, диффузные отложения солей кальция, фибриноида в ворсинах и базальной пластинке.
Рис. 2. Отложение фибриноида в прилежащем межворсинчатом пространстве
Изменения в плаценте во многом зависят от времени возникновения рецидивов и их количества. Степень деструкции более выражена у пациенток, имевших 4 рецидива и более.
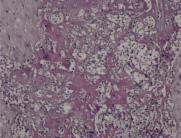
Возникновение рецидивов герпетической инфекции в III триместре беременности сочетается с альтеративными процессами в структурах последа. В базальной пластинке, септах, крупных и мелких ворсинах, амнионе, гладком хорионе обнаруживаются резко выраженные дистрофические изменения, некробиоз, очаги фибриноидного некроза. При этом имеется лимфоидно-плазмоцитарная и лимфоидно-макрофагальная воспалительная реакция, нередко с гигантоклеточным метаморфозом и очаговыми кровоизлияниями.
Рис. 3. Некроз и лимфоидная инфильтрация стромы базальной пластины у беременных с герпесвирусной инфекцией
При морфологическом исследовании последов детей, родившихся с явлениями гипотрофии, наряду с характерными изменениями и различной степени выраженности компенсаторно-приспособительными реакциями, имелось явная редукция сосудистого русла ворсинчатого хориона. Это сочеталось с повышением коэффициента плотности ворсин, который составил 4,09±0,06 и, как следствие этого, объем материнской крови в межворсинчатом пространстве был уменьшен. Эти изменения соответствовали относительно субкомпенсированной форме плацентарной недостаточности.
При морфологическом исследовании плаценты после самопроизвольного выкидыша наряду с выраженными альтернативными и воспалительными изменениями отмечалась резкая задержка развития ворсинчатого хориона, выраженный продуктивный васкулит, что сочеталось со слабовыраженными компенсаторно-приспособительными процессами и свидетельствовало о тяжелом герпетическом поражении плаценты с явлениями декомпенсированной формы хронической плацентарной недостаточности.
Заключение. Генитальная герпетическая инфекция приводит к развитию хронической плацентарной недостаточности, степень тяжести которой зависит от времени, частоты и длительности рецидивов заболевания. Изменения в плаценте характеризуются наличием как деструктивных, так и компенсаторных процессов, степень сохранности которых определяет дальнейшее развитие и состояние плода.
Беременных с данной патологией следует отнести к группе высокого риска по возможности развития плацентарной недостаточности. В план обследования пациенток с данной патологией должны быть включены современные методы диагностики состояния фетоплацентарного комплекса и морфологическое исследование последа. Выявленные морфологические изменения последа позволяют своевременно начать патогенетически обоснованную терапию новорожденных, что способствует снижению частоты тяжелых форм неонатального герпеса.
Список использованных источников:
Синцитиальные почки что это
Плацента – важный орган, основное предназначение которого – снабжение кислородом и питательными веществами развивающийся плод во время беременности. При физиологическом течении беременности плацента также обеспечивает иммунологическую толерантность организма матери по отношению к плоду, предотвращая развитие аутоиммунных реакций, являясь своеобразной «подушкой безопасности», а также выполняет эндокринную функцию, синтезируя те гормоны, которые эндокринная система плода не способна синтезировать [1, 2]. Для иммунной системы матери во время беременности баланс между реактивностью и иммуносупрессией склоняется в сторону реактивности. Однако не менее важна барьерная роль плаценты в защите плода от различных микроорганизмов. Локальные иммунные реакции могут потенциально активировать материнский иммунный ответ, что также способствует проникновению патогенных микроорганизмов в амниотическую жидкость, ткань плаценты, проникновение их в ткани, ииммунокомпетентные органы плода. Иммунная система плода ещё незрелая, не готова адекватно распознать болезнетворные бактерии и их эллиминировать. В качестве антигенов могут выступать как микроорганизмы, так и аллоантигены плода, антигены плаценты, аутоантигены матери, которые становятся мишенью для материнского организма. Независимо от их этиологии, в результате сбоя иммунной системы эти факторы могут привести к неблагоприятным результатам, таким как внутриутробная гибель плода, преждевременная роды, задержка роста плода, нарушение развития и дифференцировки внутренних органов.
Одно из первых мест в структуре акушерской патологии занимают инфекционные и воспалительные заболевания беременной, часто скрыто протекающие, достигающие 15–30 % всех преждевременных родов (ПР). Хориоамнионит (ХА) встречается примерно у 15 % беременных [3]. Распространенность ХО составляет в 3–5 % плацент доношенного срока геcтации из которых в 94 % проявляется на 21–24 неделе беременности [4]. В соответствии с современной международной морфологической классификацией повреждений плаценты, разработанной Амстердамской рабочей группой (Amsterdam Placenta Working Group) (2014) [5], воспалительные изменения плаценты делятся на изменения, обусловленные инфекционными агентами и связанные с асептическим воспалением, опосредованные иммунными процессами. В свою очередь воспаление, вызванное инфекционными факторами, бывает с преобладанием воспалительного ответа со стороны матери (преимущественно острым (например, воспаление амниотических оболочек – острый хориамнионит, или со стороны плода (васкулиты сосудов пуповины – фунизит), поражения ворсин плаценты и межворсинчатого пространства – виллиты и интервиллиты), а также децидуальной пластинки, граничащей с полостью матки – децидуит. Воспаление, обусловленное иммунопатологическими процессами, чаще бывает хроническим и представлено хроническим виллитом и хроническим ХА, хроническим децидуитом с инфильтрацией лимфоцитами и плазмоцитами, а также к хроническому воспалению относятся Т-клеточный эозинофильный фетальный васкулит, хронический гистиоцитарный интервиллузит.
Взаимосвязь инфекции влагалища и цервикального канала с ХА, разрывами плодных оболочек и преждевременными родами показано рядом авторов [6]. Однако соответствие гистологических критериев, клинических признаков воспаления и выявление возбудителя (выявленного посредством ПЦР) происходит менее чем в половине случаев [7].
Как и все органы, плацента и плацентарная площадка содержат популяции резидентных воспалительных клеток, которые, как считается, играют решающую роль в развитии и функционировании плаценты. К наиболее важным относятся популяции больших зернистых (гранулярных) лимфоцитов в децидуализированном эндометрии и клетки Гофбауэра стромы ворсин. Первые состоят преимущественно из натуральных киллеров и играют роль в трансформации и ремоделировании спиральных артерий [8], имеют тенденцию к образованию кластеров около желёз эндометрия, и материнских сосудов, но это не сопровождается повреждением тканей. Клетки Гофбауэра представляют собой тканевые макрофаги и, как полагают, принимают участие в васкуляризации ворсин плаценты и защите плода от патогенов и других потенциально опасных медиаторов, которые могут нарушить гемоплацентарный барьер [9], а также играют роль в ангиогенезе, который проявляется на этапе незрелых промежуточных ворсин, когда присутствуют клетки стромы, формирующие пространство будущего кровеносного сосуда с образованием так называемых стромальных каналов, в просвете которых циркулируют макрофаги [10], что особенно важно на ранних сроках гестации. Клетки Гофбауэра обычно по внешнему виду выглядят одинаковыми и, как правило, равномерно распределены в строме ворсин и больше представлены в плаценте на ранних сроках. Выявление в ткани плаценты и матки нейтрофилов, эозинофилов, В- и Т-лимфоцитов, а особенно плазмоцитов составляет основу для патологического воспаления ткани плаценты. Острый воспалительный ответ с преобладанием нейтрофилов наблюдается преимущественно в амниотических оболочках, при ХА, и выявляется примерно в 20 % всех плацент [11]. Хронический хориоамнионит (ХХА) воспаление с преобладанием лимфоцитов встречается в 5–15 % плацент нередко связано инфекцией, но может быть опосредовано аутоиммунными заболеваниями или аллоиммунными реакциями против последствий предыдущих инфекций или инфекций, вызванных еще нераспознанными патогенами, хотя этот вопрос требует дальнейшего изучения.
Хориамниониты являются отражением большого количества факторов риска, при котором гистологические критерии не всегда полно отражают клиническую картину. ХА часто сочетаются с воспалением других частей плацентарного диска (децидуальной оболочки (децидуит), ворсин плаценты (виллит), пупочного канатика (фунизит).
Гистологически острый хориоамнионит (ОХА) определяется как материнская нейтрофильная реакция на бактериальную инфекцию с или без сопутствующего ответа со стороны плода. ХА традиционно имеет место две основных классификации: гистологическую базирующуюся на воспалительной инфильтрации плодных оболочек (нейтрофилами, макрофагами и Т-лимфоцитами). Вторая основана на клинической манифестации локального и системного воспаления:
1) температура более 37,5 °С;
2) наличие болезненности при пальпации матки;
3) боли внизу живота;
4) неприятный запах при влагалищном исследовании;
5) тахикардия у беременной (более 100 ударов в минуту);
6) тахикардия у плода (более 160 ударов в минуту);
7) повышение лейкоцитов крови матери более 15 000 тыс/мм3) [7, 12].
Кроме того, повышение температуры тела может быть ассоциировано также с эпидуральной анальгезией, что затрудняет дифференциальную диагностику [7].
Наибольшим фактором риска в развитии острого ОХА являются микроорганизмы, присутствующие в цервико-влагалищном тракте, нарушение нормальной микрофлоры влагалища, истмико-цервикальная недостаточность, преждевременное раскрытие шейки матки и разрыв плодных оболочек, а также длительный безводный период [7]. Менее распространенными путями заражения, которые нередко не учитываются, но которые не являются менее важными, являются гематогенный путь распространения, например инфекция периодонта, а также патогенная микрофлора органов малого таза (например, инфекция мочевого пузыря, фаллопиевых труб, прямой кишки) может привести к ОХА, после проникновения микроорганизмов в ткань плаценты.
При гистологически подтвержденном ОХА анаэробные бактерии при микробиологическом исследовании выделяются примерно в 50 % случаев. В меньшем проценте наблюдений ОХА ассоциированы с более высокопатогенными организмами, представляющими угрозу жизни и здоровья плода (например, стрептококки, грамотрицательные бациллы и стафилококки), обладающие повышенной способностью к проникновению в организм плода. При ХО, обусловленных этими микрорганизмами, имеет место повышенный риск к развитию внутриутробной инфекции, а также заболеваниям неинфекционной природы, например образование очагов ишемического повреждения головного мозга, которые бывают вызваны Escherichia coli [13]. Распространенность ХО с подтверждёнными гистологическими признаками снижается в зависимости от гестационного возраста: выявляется до 70 % в плаценте от младенцев, рожденных на сроке до 30 недель гестации и приблизительно в 10 % у доношенных новорожденных [11]. Считается, что 25 % всех преждевременных родов обусловлены ХО [14], из которых ХО, ассоциированные с интактными плодными оболочками (без их разрыва) до 45 %, из них только 14–21 % случаев с гистологически подтверждённым ХО. Случаи с преждевременным разрывом плодных оболочек) (ПРО) [14] составляют 30 % наблюдений, из них только от 26 % до 50 % случаев гистологически подтверждённого ХО. Менее 5 % случаев хориоамнионита протекают наиболее тяжело, имеют угрозу для здоровья матери и плода.
Наряду с этим обнаружены микроорганизмы в ткани плаценты, которые могут не вызывать воспалительную реакцию (асимптоматическое течение ХО, однако нередко приводящие к ПРО и преждевременным родам [15]. В исследовании Hillier (1988) до 65 % наблюдений с гистологически подтверждённым ХО из плацент была выделена Ureaplasma urealyticum. Более того, данный микроорганизм был ассоциирован с другими микробными агентами и определялся более, чем в половине наблюдений [16]. Подтверждением этому служит колонизация U. urealyticum дыхательных путей плода, связанная с увеличением хронических заболеваний легких у недоношенных детей [17].
Гистологические критерии острого хориоамнионита. Классификация. Согласно Амстердамской классификации поражений плаценты выделяют материнский и фетальный воспалительный ответ. К материнскому воспалительному ответу относятся поражения плодных оболочек, к фетальному ответу – поражения сосудов пуповины, сосудов стволовых ворсин, васкулиты хориальной пластинки (рис. 1, А–Е).
Рис. 1. Воспалительные изменения хориальной пластинки и плодных оболочек (окраска гем и эоз). А–Б – Инфильтрация хориальной пластинки ПЯЛ, присутствуют лимфоциты, макрофаги и единичные плазмоциты. А – х100, Б – х200. В–Е – Острый хориоамнионит 2–3 стадии, 2 степени В – х100, Г – х200, Д – х100. Е – х400
В материнском воспалительном ответе выделяют стадии, отражающие прогрессию заболевания.
Стадия 1. (острый субхориоамнионит/ранний острый хориоамнионит) = очаговое и диффузное скопление полиморфно-ядерных лейкоцитов (ПЯЛ) в и под хориальной пластинкой и/или в и под амниотической базальной мембраной (отмечаются несколько разбросанных ПЯЛ в менее чем в половине толщины хориальной пластинки и / или в соединительной ткани мембранозной части хориальной пластинки). Воспалительная инфильтрация отмечается лишь под хориальной пластинкой, в последующем нейтрофилы инфильтрируют также как плодный фибриноид под хориальной пластинкой, так и границу децидуальной и хориальной пластинок (острый субхорионит), а затем вовлекаются децидуальные посткапиллярные венулы (острый хорионит). Эта стадия длится обычно менее 12 часов.
Стадия 2. Острый хориоамнионит. Количество нейтрофилов увеличено в хориальной пластинке и / или мембранозной части хориальной пластинке оболочках амниона. Стадия длится в течение 12–24 часов
Стадия 3. Некротический хориоамнионит. Отмечается распад ПЯЛ (кариорексис), утолщение амниотической базальной мембраны, которая становится эозинофильной, присутствует также дистрофия и слущивание амниотического эпителия. После длительной экспозиции инфекции (>48 часов) нейтрофилы подвергаются кариорексису, слущенные амниотические эпителиальные клетки проникают в амниотическую жидкость, что является следствием появления ярко-красной полосы фибриноида на базальной мембране амниона. Это обнаруживается в 50 % случаев и является признаком некротического хориоамнионита.
Спустя несколько дней или недель острые воспалительные инфильтраты стихают и смешанная нейтрофильно-гистиоцитарная инфильтрация сохраняется только в верхних слоях хориона. Этот вариант ХО был назван подострым ХО, который коррелирует с увеличением заболеваемости хроническими заболеваниями легких новорожденных [18]. Важно, что наличие субхориальных микроабсцессов на любой стадии инфекции является проявлением повышенного риска развития тяжелых осложнений, включая сепсис [19].
Степень хориоамнионита (отражает выраженность воспалительных реакций)
Степень 1 (умеренно выраженная): присутствуют единичные или мелкие скопления материнских ПЯЛ, диффузно инфильтрирующих амниотические оболочки, хориальную пластинку и/или расположенный под хориальной пластинкой плодный фибриноид.
Степень 2 (тяжёлая): присутствие трех или более микроабсцессов в хориальной пластинке (не менее 10–20 ПЯЛ), а также между хориальной и децидуальной пластинками в экстраплацентарных оболочках и / или под хориальной пластинкой плацентарного диска. Поражение может иметь вид непрерывной линии из более 10 ПЯЛ, занимающую более половины плодного фибриноида, расположенного под хориальной пластинкой или один оборот в «ролле» плодных оболочек. Хронический (или подострый) ХО диагностируется на основании более выраженной инфильтрации мононуклеарами (обычно макрофагами), в хориальной пластинке (чаще под амнионом). В ряде случаев макрофаги присутствуют как реакция на отложение экзогенных пигментов (например, мекония или гемосидерина).
Фетальный воспалительный ответ
Стадии, отражающие прогрессию заболевания.
Стадия 1 (васкулит хориальных сосудов / флебит пупочной вены): выявление ПЯЛ в стенке сосудов хориальной пластинки или стенке пупочной вены. Проникновение ПЯЛ в вартонов студень допустимо при этой стадии, но пока отсутствуют микроабсцессы и концентрические полосы, окружающие пупочную вену.
Фетальный воспалительный ответ, обусловленной инфильтрацией ПЯЛ на бактериальную инфекцию при беременности, может развиться с 15 недели гестации, но значительно чаще имеет место при доношенных сроках беременности [20]. Фетальный воспалительный ответ начинается с сосудов хориона или пупочной вены, практически всегда сопровождается материнским ответом в виде острого (подострого) хориоамнионита. Острый васкулит фетальных сосудов как изолированное состояние является дискутабельным вопросом.
Стадия 2 (васкулит пупочных сосудов): нейтрофилы присутствуют в стенке одной или обеих пупочных артерий и в пупочной вене. Наличие ПЯЛ в вартоновом студне допустимо при отсутствии микроабсцессов, и концентрических полос, окружающих пупочные сосуды. Фетальные воспалительные реакции в стенке пупочных артерий (пупочный артериит) возникают позже, их развитие коррелирует с повышенным уровнем циркулирующих цитокинов в пупочной крови).
Впоследствии ПЯЛ могут мигрировать в вартонов студень пуповины, где они образуют полоску, выявляемую при гистологическом исследовании, окружающие фетальные сосуды (стадия 3).
Стадия 3 (некротический фунизит или концентрический периваскулит пупочных сосудов): диагностируют на основании присутствия ПЯЛ, клеточного детрита, эозинофильных преципитатов, и/ или отложений солей кальция, которые визуализируются в виде полоски или ободка, окружающих один или все пупочные сосуды (в большинстве случаев наиболее тяжёлые изменения присутствуют на участках близким к периферии пуповины). Полосу или ободок, который образуют ПЯЛ некоторые авторы называют некротический или субнекротический фунизит и связывают с отложением иммунных комплексов, состоящих из бактериального антигена амниотических оболочек и материнских иммуноглобулинов, диффундирующих из пупочных сосудов [21]. Через несколько недель клетки и эти аркуатные структуры могут исчезнуть, и смениться на эозинофильнуые преципитаты, микрокальцинаты, при этом нередко вовлекаются хориальные сосуды мелкого диаметра (рис. 2, А–Г).
Рис. 2. Воспалительные изменения пуповины и децидуальной пластинки (окраска гем. и эоз.). А–Г – Воспалительные изменения пуповины (воспалительная инфильтрация вартонова студня лимфоцитами, макрофагами и ПЯЛ) А – х40, Б – х100, В – х200, Г – х200. Д–Е – Воспалительные изменения базальной пластинки (очаговая и рассеянная инфильтрация преимущественно ПЯЛ), Д – х100, Е – х200
Степень, отражающая интенсивность воспаления фетального воспалительного ответа
Степень 1 (умеренно выраженная): разбросанные инфильтраты, образованные ПЯЛ, расположены субэндотелиально или стенках хориальных или пупочных сосудов.
Степень 2 (тяжелая): стенки сосудов хориальной пластинки (или сосудов пуповины) с выраженной инфильтрацией ПЯЛ и отёком, наличием повреждения гладкомышечной стенки сосудов на стороне, близкой к амниотической полости. Кроме того, часто отмечаются тромбозы фетальных сосудов (свежие тромбы в сосудах хориальной пластинки или пуповины). Все эти признаки являются отражением картины фетального воспалительного ответа – англ. fetal inflammatory response syndrome (FIRS) – по аналогии с SIRS (англ. Systemic inflammatory response syndrome). Важно отметить, что воспалительный ответ плода не всегда свидетельствует о фетальной инфекции, но является показателем иммунной активации, которая ассоциируется с высокими уровнями цитокинов плода, что приводит к увеличению риска повреждений головного мозга и заболеваний лёгких плода [22–24]. При 2 степени тяжести васкулиты хориальных сосудов ассоциированы с повышенным риском ишемического повреждения головного мозга плода; тромбы в их просвете являются также дополнительном фактором риска [25].
Другие специфические изменения
К другим специфическим изменениям плаценты, ассоциированным с ОХА, относится: периферический фунизит, диагностируемый на основании наличия мелкоточечных абсцессов с участками инфильтрации ПЯЛ на внешней стороне пуповины; острый виллит: присутствие ПЯЛ в строме ворсин и /или под трофобластом; острый интервиллузит / внутриворсинчатый абсцесс – ПЯЛ располагаются в пределах периворсинчатого фибриноида или периворсинчатого пространства, а также в ряде случаев отмечается инфильтрация ПЯЛ децидуальной пластинки (острый децидуит) (рис. 2, Д–Е).
Другие воспалительные изменения, ассоциированные с ОХА, особенно на ранних сроках гестации, включают лимфоплазматический децидуит, и свежие ретроплацентарные гематомы вызывающие диагностическую сложность из-за интенсивной инфильтрации ПЯЛ. В некоторых случаях ОХА могут быть вызваны специфическими микроорганизмами. Так, ОХА с острым интервиллузитом и образованием межворсинчатого абсцесса (так называемые септические инфаркты) чаще всего ассоциируются с Listeria monocytogenes [26, 27]. ОХА с ассоциации с периферическими абсцессами пуповины наиболее часты при инфекции Candida, и часто связаны с преждевременным разрывом плодных оболочек, истмико-цервикальной недостаточностью, а также присутствием внутриматочной спирали или вагинальных колец [28]. ОХА в сочетании с острым виллитом наблюдаются при врождённом бактериальном сепсисе, обычно вызванном стрептококками или грамотрицательными бактериями, в частности E. coli. ОХА в ассоциации с очаговым острым интервиллузитом и периворсинчатым отложением плодного фибриноида могут сочетаться с материнским сепсисом, нередко вызываемого стрептококками и грамотрицательной флорой [29]. Гибель плода редко является следствием непосредственно ОХА, гораздо чаще это происходит при развитии врождённого сепсиса. Преждевременные роды, связанные с ХО, имеют высокий риск рецидива. К возможным причинам этого относят наличие дефектов матки, подострого хронического эндометрита, вызванного стрептококками группы В, бактериального вагиноза, истмико-цервикальной недостаточности.
Изолированный фетальный васкулит может поражать артерии и вены пуповины, хориальной пластинки или крупных стволовых ворсин. Хотя обычно сопровождается острым хориоамнионитом или хроническим виллитом, эти повреждения иногда могут наблюдаться изолированно. Поражения с инфильтрацией ПЯЛ или смешанной воспалительной инфильтрацией (с примесью ПЯЛ) и/или эозинофилами чаще всего обусловлены воздействием мекония, более часто встречаются в стенке пупочной вены [30]. Наблюдения с лимфоцитарной или смешанной лимфоцитарной / эозинофильной инфильтрацией (эозинофильный Т-клеточный хорионический васкулит) имеют место в хориальных или крупных сосудах стволовых ворсин, но данный вопрос является недостаточно изученным [31, 32].
Хронический хориоамнионит (ХХ) встречается в двух различных клинико-патологических вариантах [33]: подострый (хронический) хориоамнионит, является преимущественно затяжной формой инфекционного хориоамнионита и связан чаще с микроорганизмами с низкой патогенностью, такими как микоплазма или вагинальные анааэробы [18]. Один из морфологических вариантов представлен преобладающей воспалительной инфильтрацией гистиоцитами, мононуклеарами с примесью единичных нейтрофилов под амнионом. Этот вариант сочетается с экстремально низкой массой тела детей при рождении и является одной из причин преждевременных родов, часто сочетается с хроническим виллитом. Второй морфологический вариант диагностируется как преобладание лимфоцитарной инфильтрации, по выявленной локализации в хорионе в средней части амниона в виде полос.
Хронический децидуит (ДХ) диагностируется на основании обнаружения инфильтрации мононуклеарами и/или с наличием плазмоцитов [34]. В ряде случаев обнаруживается также большое количество эозинофилов.
Есть предположение, что ДХ может быть результатом эндометритов низкой степени активности и подострых эндометритов, вызванных микоплазмой или другими микроорганизмами с низкой патогенностью, что может быть связано с нарушением микрофлоры влагалища [35]. Это может приводить к преждевременным родам во втором и третьем триместрах. ДХ часто сочетаются с ХО.
Известно, что при отсутствии лечения хронический эндометрит – фактор высокого риска при невынашивании беременности. Кроме того, хронические виллиты сочетаются в 25–30 % случаев с лимфоплазмоцитоидными хроническими децидуитами.
В этих случаях ДХ могут представлять собой неинфекционный воспалительный материнский ответ на аутоантигены или аллоантигены плода [36]. Пациенты с ДХ часто имеют высокий процент аутоиммунных заболеваний различного генеза [37]. Общая перинатальная смертность высока. Антенатальная гибель плода, привычное невынашивание беременности также часто ассоциированы с ДХ. У выживших младенцев нередко отмечается задержка роста и развития. Данное состояние следует также отличать от морфологической картины, при инфицировании Plasmodium falciparum во время беременности.
Децидуальный васкулит/периваскулит диагностируется по наличию выраженности воспалительной инфильтрации вокруг артериол децидуальной пластинки, включая децидуальную пластинку плодных оболочек [3, 38, 39]. Это поражение наиболее часто наблюдается у пациентов с преэклампсией, задержкой развития плода, при невынашивании беременности. Децидуальный васкулит может быть как изолированным, так и сочетаться с острым атерозом и гипертрофией стенок сосудов [39].
Хотя интраамниотическая инфекция обычно считается причиной острого хориоамнионита и фунизита, а также причиной преждевременного разрыва плодных оболочек, однако данные ряда авторов свидетельствуют о том, что «асептическое» внутриамниотическое воспаление (без выявленного микробного агента), может происходить в отсутствии видимых микроорганизмов, и повреждающее действие связано с молекулами повреждения или молекулы «опасности» (DAMP – от англ. Damage-associated molecular pattern или danger-associated molecular patterns), а также интерлейкинами, хемокинами и другими «сигналами опасности». В контексте внутриамниотической инфекции интерлейкины и хемокины (например, интерлейкин-8 и хемотаксические факторы гранулоцитов) создают градиент, который способствует миграции нейтрофилов из системы кровообращения матери или плода в плодные оболочки или пуповину, соответственно. Молекулы повреждения, которые высвобождаются в при повреждении и гибели клеток также в свою очередь могут способствовать высвобождению хемокинов и нейтрофилов [40].
Таким образом, восходящий тип инфекции, обусловленный воспалительным ответом, вызываемый микробными агентами вовлекает 2 типа иммунного ответа: (1) материнский, с инфильтрацией воспалительной инфильтрации (прежде всего ПЯЛ) хориоамниона и хориальной пластинки; и (2) фетальный, определяемый как воспалительная инфильтрация (преимущественно ПЯЛ) вартонова студня, стенок крупных сосудов хориальной пластинки и сосудов пуповины.