синдром мидаса что это такое
Миодистрофия Дюшенна: что это такое?
Время чтения: 10 мин.
Доктор медицинских наук, президент благотворительного фонда «Гордей» и бабушка Гордея, мальчика с диагнозом миодистрофия Дюшенна, Татьяна Андреевна Гремякова рассказывает о том, что это за болезнь, почему ее часто принимают за гепатит, и что необходимо делать, чтобы дети с этим диагнозом как можно дольше сохраняли активность и жили полной жизнью.
Мышечная дистрофия Дюшенна (МДД) — одно из наиболее распространенных среди редких (орфанных) генетических фатальных нейромышечных заболеваний. В большинстве случаев оно встречается только у мальчиков.
Заболевание развивается вследствие мутации гена, который отвечает за синтез белка дистрофина. У детей прогрессирует повреждение и дегенерация мышц. Со временем мышцы слабеют до такой степени, что дети/подростки не могут самостоятельно передвигаться — в возрасте 10-15 лет мальчики садятся в инвалидную коляску. Параллельно у них развиваются кардиореспираторные нарушения — проблемы с сердцем и дыханием. В возрасте 15-20 лет им уже требуется респираторная поддержка: вначале только ночью, а в дальнейшем – круглосуточно.
Сегодня, благодаря профилактике формирования контрактур, сколиоза и кардиомиопатии, применению стероидов, внедрению респираторной поддержки и другим превентивным мерам, удалось существенно продлить функциональную активность пациентов,
качество и продолжительность их жизни.
Ожидаемая продолжительность жизни мальчиков с МДД, рожденных в последние годы в развитых странах (при условии, что им доступна современная реабилитация, терапия и респираторная поддержка), — 30-40 лет.
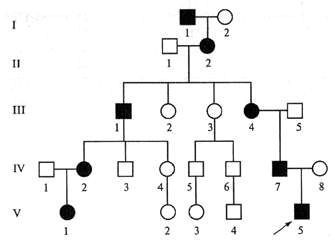
Болезнь в большинстве случаев передается от матерей, но сами женщины от нее практически не страдают: они бессимптомные или малосимптомные носители дефектного гена. Ген может передаваться по женской линии многие поколения и никак не проявляться, поэтому рождение ребенка с дистрофией Дюшенна для семьи часто становится неожиданностью. В трети случаев болезнь – результат спонтанной мутации плода без семейной истории.
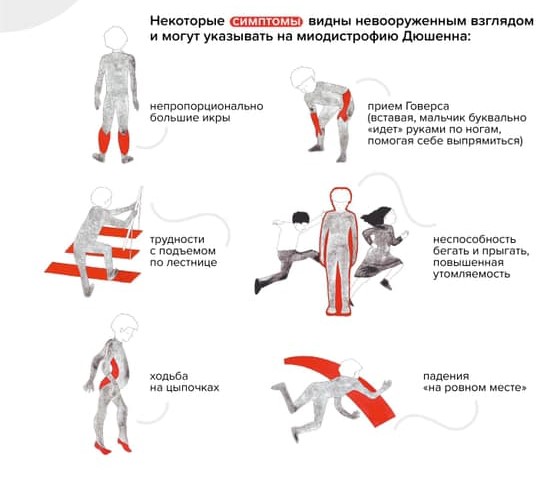
В начале болезнь распознать трудно: симптомы проявляются не сразу и нарастают постепенно. Чаще всего до четырех-пяти лет врачи и родители считают, что малыш здоров. У ребенка могут быть некоторые задержки двигательного и речевого развития, он может быть неуклюжим, часто падать и быстро уставать. Мальчик с МДД не бегает так быстро, как сверстники, не прыгает. Родителям зачастую видны некоторые особенные нюансы взросления, но никаких «красных флагов», которые позволили бы серьезно обеспокоиться, нет довольно долго.
Ребенок растет, со временем меняется его походка и осанка. Можно заметить, что он ходит на носочках. Ему трудно вставать с пола — поднимается, опираясь на руки (прием Говерса).
«Прием Говерса» и другие вероятные признаки наличия у ребенка миодистрофии Дюшенна / Фонд «Гордей»
Обращает на себя внимание увеличение икроножных мышц. Позднее трудности при ходьбе нарастают: ребенок с трудом поднимается по лестнице, у него совсем нет сил. В какой-то момент он вовсе перестает ходить и садится в инвалидную коляску.
Если есть сомнения относительно здоровья мальчика, то первое, что нужно сделать, — анализ крови на активность креатинфосфокиназы (КФК). Это фермент, содержащийся в скелетных мышцах, маркер их распада. Обычно при МДД он бывает выше нормы во много раз — например, несколько десятков тысяч единиц при норме в сотню.
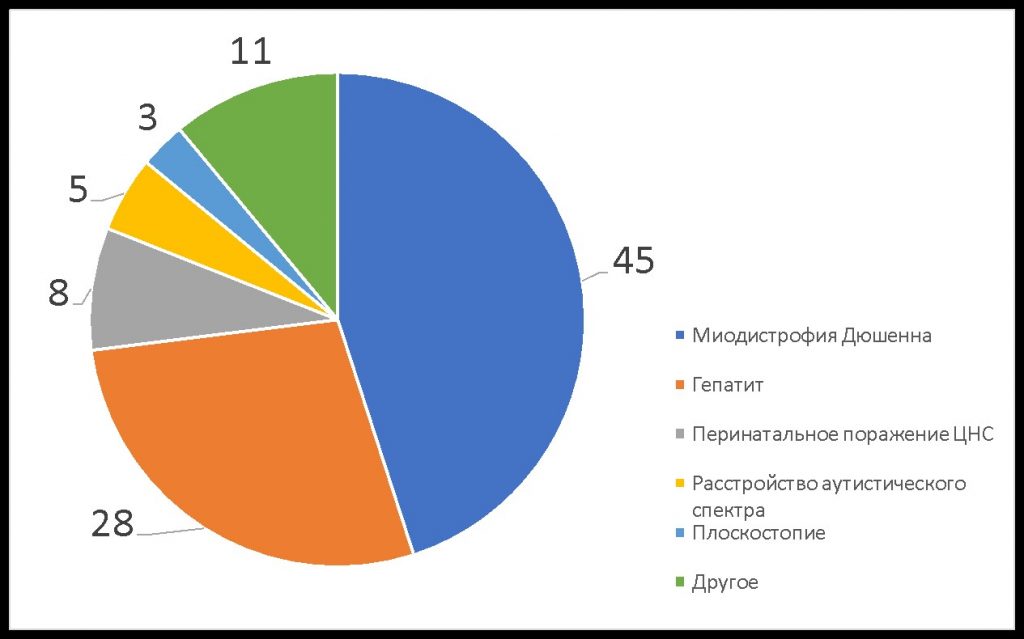
МДД — редкое заболевание. Врачи могут ни разу за свою практику не столкнуться с ним и не знать, что делать. Часто ребенку ошибочно ставят диагноз гепатит, перинатальное поражение ЦНС и/или аутизм и назначают лечение, подчас ускоряющее прогрессирование Дюшенна (Рис. 1).
Рис. 1. Результаты опроса
200 родителей (%): «Какой первый диагноз был поставлен мальчику с миодистрофией Дюшенна в первичном поликлиническом звене?»
Почему гепатит — самый частый из неверных диагнозов? При МДД в крови повышаются уровни трансаминаз, что ошибочно принимается за симптоматику гепатитов. Но эти ферменты в случае МДД мышечного, а не печеночного происхождения.
Если выявлено увеличение уровня КФК выше критического (более 2000 ед), необходимо делать генетический анализ и искать мутацию в гене дистрофина.
Информация для медицинских специалистов
Ген дистрофина — один из самых больших в человеческом организме. Он состоит примерно из 2,5 млн пар нуклеотидов, содержит 79 экзонов, размер гена 2,2 Мб. Уровень мутаций гена относительно высок: в одном из трех случаев МДД вызывается мутацией de novo (впервые возникшее изменение, в отличие от унаследованного – прим.ред). Таким образом, новые случаи возникают даже при наличии хороших инструментов пренатальной диагностики и семейного консультирования для известных случаев.
Высокая частота мутаций также лежит в основе большого разнообразия мутаций, выявленных у пациентов с МДД. Наиболее часто встречаются делеции (
68%), затем по частоте идут дупликации (
11%) одного или нескольких экзонов, реже обнаруживаются небольшие мутации (∼20% пациентов). Мутации могут происходить на любом участке гена, но делеции чаще сконцентрированы между экзонами 45–55, а дупликации — между экзонами 2–10. Тип и расположение мутации определяют ход течения заболевания и то, какое лечение требуется больному.
Сейчас в России применяется специфическая молекулярно-генетическая диагностика повреждения гена дистрофина, определение мутации в каждом конкретном случае.
Генетическое тестирование позволяет точно поставить диагноз. Ранняя и прецизионная диагностика больных МДД необходима для правильного сфокусированного назначения этиопатогенетической терапии. Фактически каждому такому ребенку требуется персонализированная терапия в зависимости от типа и локализации мутации гена.
Бесплатная генетическая диагностика проводится больным с диагнозом МДД, а также бессимптомным пациентам с высокими значениями КФК (более 2000 ЕД\л) с 2019 года. Ограничений по возрасту исследуемых больных нет.
Как попасть на генетическую диагностику?
Диагностику проводят в ФГБНУ «Медико-генетический научный центр имени академика Н.П. Бочкова». Направить на диагностику может только врач. Для этого он должен позвонить на Горячую линию по номеру 8-800-100-17-60 (линия предназначена исключительно для врачей) и зарегистрировать пациента в программе бесплатного генотипирования. В этом случае транспортные услуги по перевозке биоматериалов также будут бесплатны.
Только в 30% случаев больной ребенок рождается в результате спонтанной мутации. В 70% случаев носителем мутации является мама ребенка, которая, как правило, не знает об этом.
При планировании беременности женщинам желательно сделать генетический тест на носительство МДД. В некоторых странах такой тест обязателен.
Оценка функциональной активности ребенка позволяет понять его состояние и спрогнозировать дальнейшее течение заболевания. Для этого заболевания нет биохимических маркеров течения болезни. Изменение функциональной и физической активности у детей с МДД выражается в числовых значениях. Это позволяет понять степень выраженности болезни и динамику ее клинической симптоматики.
Если ребенок ходит, его состояние оценивают по методу The North Star (NSAA). Дополнительно оценивается расстояние, пройденное за 6 минут, и время подъема и спуска с четырех ступеней.
Для тех, кто потерял способность ходить, есть метод оценки работы рук — Performance of Upper Limb (PUL) test.
Физическая терапия и реабилитация — основа ухода за больными с МДД на протяжении всей жизни. Она нужна, чтобы поддерживать физическую активность и функциональность.
Современная реабилитация ориентирована:
На более поздних этапах болезни это:
Тутора для ребенка с миодистрофией Дюшенна / Фонд «Гордей»
Для сохранения способности ходить важно следить за постановкой ног ребенка на полную стопу, а также уделять внимание растяжке, особенно мышц голеностопа. Иначе через некоторое время мальчик сможет ходить только на цыпочках, и тогда ему понадобится коляска.
Занятия в бассейне / Фонд «Гордей»
Если не заниматься физической терапией, ребенок может потерять способность ходить рано и сесть в коляску в 7-8 лет.
В результате начнутся серьезные изменения, в первую очередь, позвоночника: сильный сколиоз, требующий операции на позвоночнике, пострадают сердце и дыхание.
Реабилитация и физическая терапия способны надолго продлить двигательную активность больного.
Позиционирование на стадии коляски фокусируется на том, чтобы сохранить правильное положение тела и ног, не допустить развития сколиоза и контрактур в суставах, сохранить максимальный объем движений рук.
В наиболее тяжелой стадии заболевания важна респираторная реабилитация.
Медицинская помощь
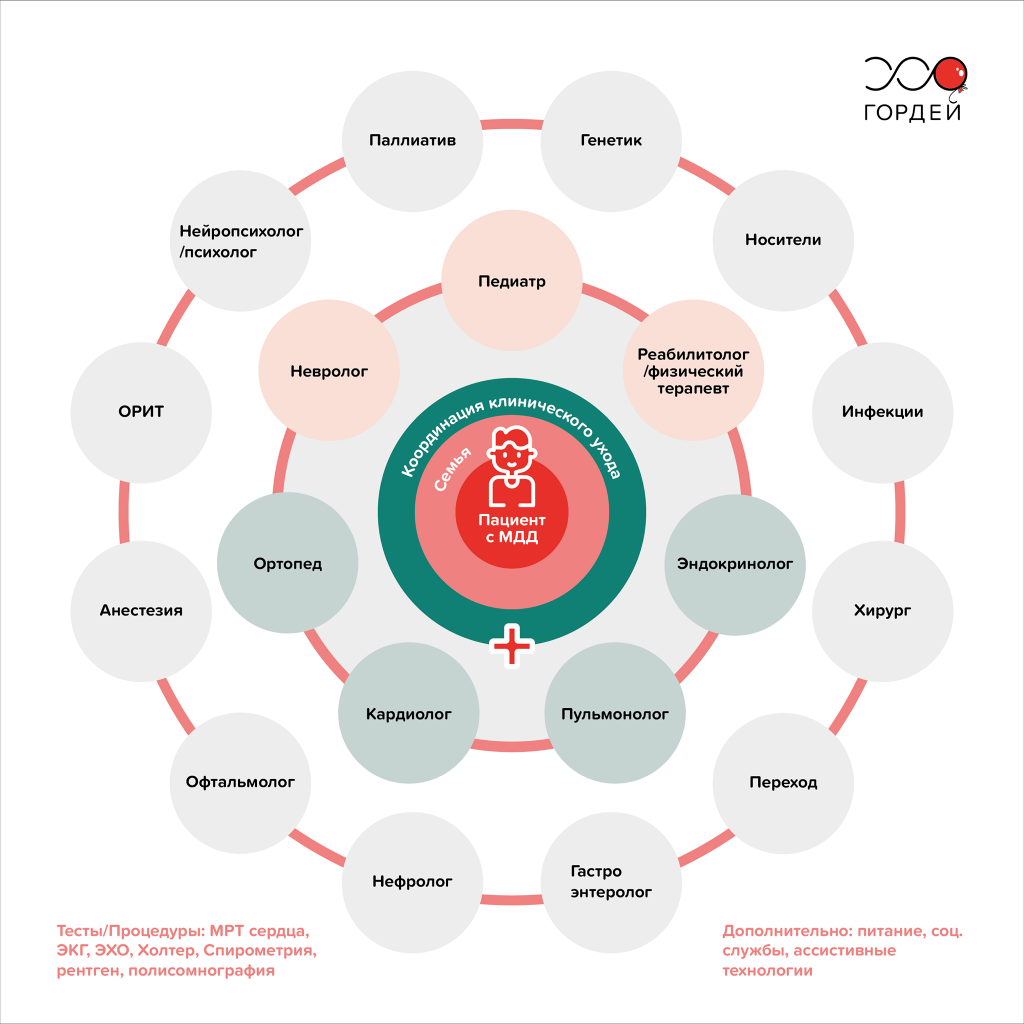
Миодистрофия Дюшенна — прогрессирующее заболевание, которое со временем поражает многие системы и органы человека. А значит, вести пациента с МДД должна мультидисциплинарная команда врачей под руководством специалиста по нервно-мышечным заболеваниям (например, педиатр или детский невролог).
По мере взросления ребенка эта функция переходит к неврологу, работающему со взрослыми пациентами. Следует заранее определить необходимых специалистов, чья помощь понадобится уже взрослому пациенту.
В современной медицинской и паллиативной концепции ведения пациентов с МДД считается важным ориентироваться на его семью: общаться, координировать уход, информировать об ожидаемых изменениях, связанных с болезнью.
Какие врачи ведут пациента с МДД
| Специалист | Сфера ответственности |
|---|---|
| Невролог | Комплексное ведение болезни на протяжении всей жизни. |
| Реабилитолог | Упреждение развития контрактур и деформации, минимизация боли, продление функциональности и способности к передвижению. |
| Ортопед/Хирург | Поддержка двигательных функций как можно дольше, минимизация контрактур суставов, поддержка позвоночника в прямом положении. |
| Эндокринолог (поддержание костного здоровья) | Уменьшение прогрессирования остеопороза, восстановление при ранних признаках остеопороза. |
| Эндокринолог (рост и половое созревание) | Минимизация нарушений роста, коррекция пубертатного развития, развитие и предотвращение опасного для жизни криза надпочечников. |
| Пульмонолог | Уменьшение респираторных осложнений и сохранение функции дыхательных мышц. |
| Кардиолог | Максимальное продление работы сердца, упреждение формирования сердечной недостаточности и других отклонений. |
| Гастроэнтеролог и диетолог | Профилактика недостаточного или плохого питания, избыточного веса и ожирения. |
| Психолог | Психосоциальная поддержка на протяжении всей жизни, помощь в планировании будущего и формировании представлений о том, как пациенты будут активно участвовать в уходе за собой и ежедневной деятельности. |
| Паллиативная помощь | Симптоматическая терапия, предоставление технических средств реабилитации и медицинских изделий, социальная поддержка. |
Рис. 2. Схема организации мультидисциплинарного ухода за пациентами с миодистрофией Дюшенна на протяжении всей жизни / Фонд «Гордей»
Транзит во взрослую медицину и жизнь
Человек с заболеванием, которое начинается в детском возрасте и ведется детскими врачами, взрослея, переходит во взрослую медицинскую и паллиативную службу. Переход обычно происходит в возрасте от 17 лет до 21 года, в зависимости от системы здравоохранения. Однако, чем старше становится больной с МДД, тем больше он нуждается в медицинской помощи и уходе — ведь болезнь прогрессирует. А значит, без поддержки семьи и медиков не обойтись.
К сожалению, не все больные МДД смогут перейти к самостоятельной и долгой взрослой жизни. Первая причина: около трети молодых взрослых с МДД испытывают психосоциальные трудности или страдают когнитивными нарушениями, которые ограничивают самостоятельность и независимость. Вторая причина: различное течение заболевания.
Обе причины зависят от множественности мутаций гена дистрофина: от чрезвычайно злокачественной, когда дети вовсе не научаются ходить, до доброкачественной, похожей по течению и сроку жизни на миодистрофию Беккера (Birnkrant DJ, Bushby KM, Bann CM, и др., Диагностика и ведение пациентов с мышечной дистрофией Дюшенна, часть 3: первичная помощь, неотложная помощь, психосоциальная помощь и преемственность в оказании помощи на протяжении жизни пациента., The Lancet Neurology, 2018; том 17: 445-55′).
И все же для большинства молодых взрослых с МДД следует прогнозировать полноценное участие в планировании будущего и принятии решений.
Есть ли лекарство?
Сделать лекарство для МДД сложно: один препарат не вылечит всех, как при СМА. Больные МДД, как снежинки: нет одинаковых — уже описано около десяти тысяч мутаций гена. Поэтому болезнь по-разному проявляется — даже в одной семье у двух братьев.
Уже есть одобренные патогенетические лекарства, а препарат для коррекции нонсенс-мутаций в ноябре 2020 года зарегистрирован в России. Несколько препаратов находятся в третьей стадии клинических исследований. Одна из самых обнадеживающих перспектив — доставка в мышечную клетку исправленной укороченной копии гена дистрофина с помощью AAV вирусов: именно они могут перенести нужный фрагмент ДНК.
Какие перспективы?
Дети, которым диагноз «миодистрофия Дюшенна» ставится сегодня, будут жить по-другому — лучше и дольше, чем больные, рожденные 10-20 лет назад. Разработаны международные стандарты ухода, накоплен большой опыт, позволяющий предупредить развитие тяжелых осложнений болезни, продлить стадию функциональной активности ребенка, на горизонте — генетическая терапия, которая подойдет многим. Уже сейчас доступны четыре патогенетических препарата для определенных мутаций. В 2020 году в России зарегистрирован первый препарат для лечения миодистрофии Дюшенна — Аталурен.
Кто поможет?
Фонд «Гордей» создала семья, в которой растет Гордей — семилетний мальчик с миодистрофией Дюшенна. Цель фонда – улучшить на системном уровне качество диагностики, ведения, ухода, реабилитации и лекарственного обеспечения больных МДД.
Гордей с мамой, Ольгой Гремяковой. Фото из личного архива / Facebook
Одна из основных задач фонда – информирование и повышение осведомленности о миодистрофии Дюшенна врачебного и родительского сообщества. Чтобы практикующие и будущие педиатры, детские неврологи, медработники детских садов и школ знали о симптомах заболевания, а профильные специалисты имели возможности для обучения, стажировок, обмена опытом и в своей работе опирались на международные стандарты ухода и лучшие мировые практики.
Президент фонда «Гордей», доктор медицинских наук и бабушка Гордея, Татьяна Андреевна Гремякова ежемесячно проводит Школу для родителей вновь диагностированных детей с Дюшенном: отвечает на вопросы, помогает родителям понять, что именно они могут сделать для своего ребенка уже сегодня и что происходит в науке и медицине по данной нозологии.
Учредитель фонда «Гордей», психолог и мама Гордея, Ольга Гремякова два раза в месяц проводит «Передышку» — группу поддержки для мам и пап и вебинары, помогающие родителям развивать жизнестойкость, справляться со стрессом, возвращать себе контроль над своей жизнью. Для родителей вновь диагностированных мальчиков есть индивидуальные консультации с психологом.
Чтобы записаться на ближайшую Школу, «Передышку» или на индивидуальную психологическую консультацию, нужно написать по адресу: go@dmd-russia.ru
Сообщество фонда «Гордей» в Фейсбуке.
Сообщества по таргетной (подходящей для определенных мутаций) терапии:
Для родителей детей с «нонсенс-мутацией».
Для родителей детей с одной из делеций, корректируемых пропуском экзона 45.
Для родителей детей с одной из делеций, корректируемых пропуском экзона 51.
Для родителей детей с одной из делеций, корректируемых пропуском экзона 53.
С МДД также работают следующие организации:
Федеральные центры, работающие с МДД:
Материал подготовлен с использованием гранта Президента Российской Федерации, предоставленного Фондом президентских грантов.
Что такое синдром Марфана? Причины возникновения, диагностику и методы лечения разберем в статье доктора Боровиковой Ольги Игоревны, гинеколога-эндокринолога со стажем в 6 лет.
Определение болезни. Причины заболевания
Синдром Марфана (Marfan; СМ) — генетически обусловленное заболевание, при котором происходит системное поражение соединительной ткани. [1]
Причины синдрома Марфана
Этиологией заболевания является мутация в гене FBN1 (фибриллина 1), расположенном в коротком плече пятнадцатой хромосомы в локусе 21.1. [2]
Тип наследования синдрома — аутосомно-доминантный. Для болезни характерна высокая пенетрантность (частота появления гена) и различная экспрессивность. [5]
Соотношение представителей мужского пола и женского одинаковое.
Симптомы синдрома Марфана
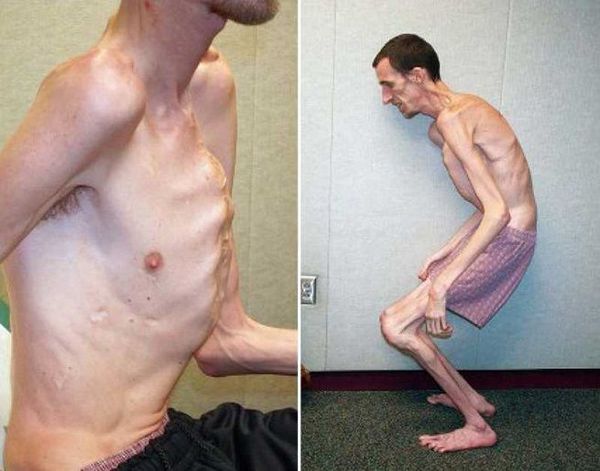
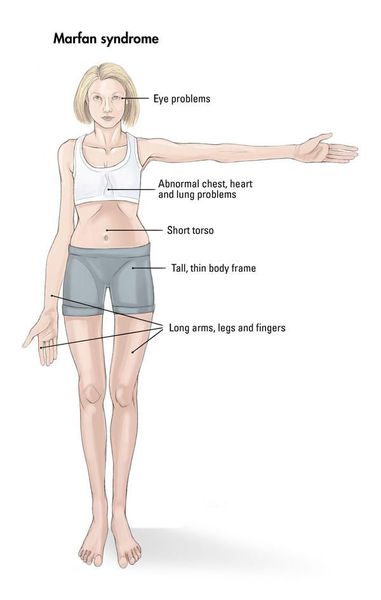
Наблюдается постоянно прогрессирующее развитие заболевания. У новорожденных детей выявляются удлинённые тонкие пальцы на верхних и нижних конечностях и удлинённые тонкие конечности (долихостеномелия). [1] У таких пациентов, помимо долихостеномелии, отмечается:
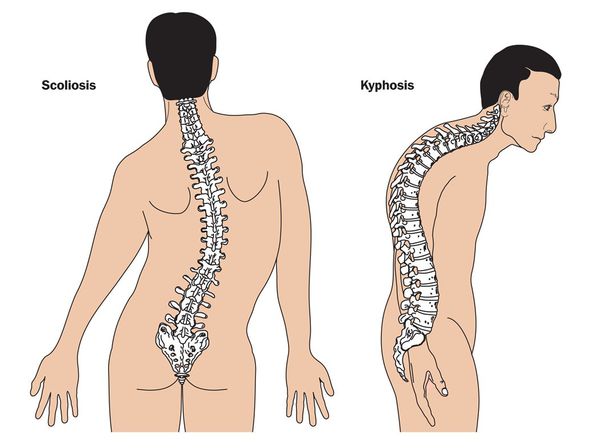
Кожа имеет повышенную растяжимость, разболтанные суставы. У большинства больных наблюдается высокое аркообразное нёбо, изменения формы грудной клетки (воронкообразная, килевидная) и искривления позвоночника (сколиоз в 60%, кифоз (изгиб позвоночника с образованием горба), ювенильный остеохондроз), уплощение свода стопы, аускультативные признаки порока сердца (шумы). [4] Длина третьего пальца руки — 10 см и больше (скрининговый тест у детей 7-18 лет): возрастает соотношение размаха верхних конечностей к длине тела.
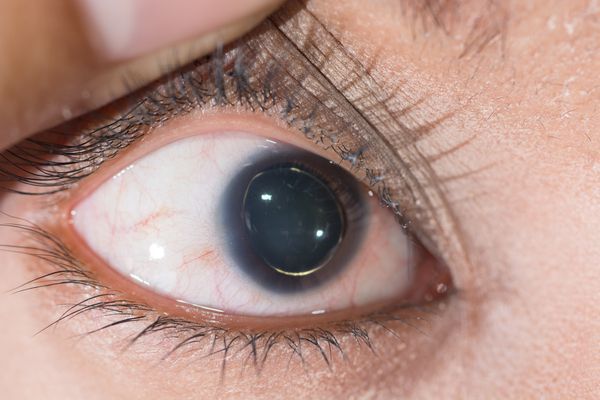
Офтальмологические симптомы (близорукость, подвывих хрусталика в 75% случаев, его округлость или гипоплазия, отслойка сетчатки) и астенические признаки (усталость, вялость) обращают на себя внимание со второго года жизни, изменения формы грудной клетки появляются в возрасте старше четырёх лет, патология сердца и сосудов выявляется в дошкольном возрасте. [1]
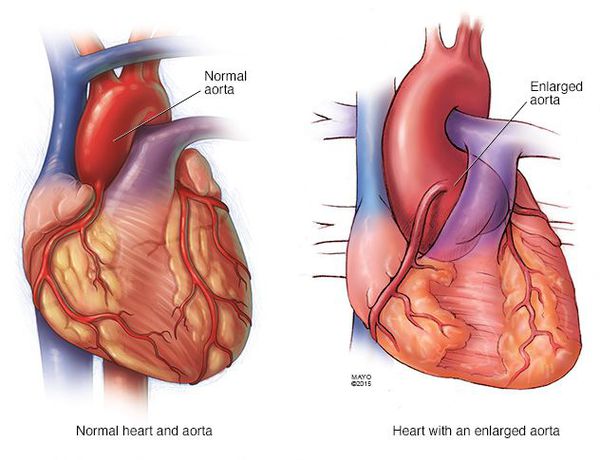
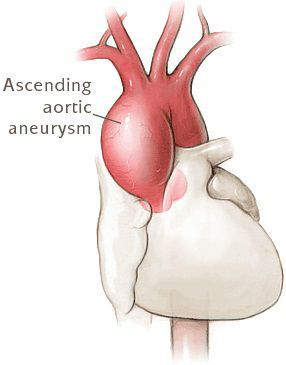
Почти у всех больных выявляются пороки сердца и аорты. Часты бедренные и паховые грыжи, поражение клапанов в венах, их варикозное расширение, геморрагический синдром, рецидивирующие вывихи, поражение лёгочной системы (самопроизвольный пневмоторакс, эмфизематозное расширение лёгких), опущение почек. [2]
В четверти случаев зарегистрировано снижение интеллекта, у половины пациентов выявляются нарушения эмоционально-волевой сферы. Часто появляются депрессивные состояния, нейроциркуляторная дистония. [3]
По данным многих исследований, абсолютное большинство больных с синдромом Марфана отмечают ухудшение эмоционального фона, утрату чувства радости и увлечённости профессиональной деятельностью, частую смену настроения, повышенную возбудимость, чувство тревоги. Результатом этого является снижение социальной активности, ухудшение качества жизни и значительное уменьшение социальной адаптации. [3]
У таких пациентов часто наблюдается трахеобронхиальная дискинезия (нарушение дыхательной системы) за счёт слабости соединительнотканного каркаса бронхов. Это проявляется рецидивирующими воспалительными заболеваниями бронхолегочной системы, обструктивными нарушениями, бронхиальной астмой, эмфиземой лёгких (повышенное содержание воздуха в лёгочной ткани). [4] Встречаются осложнения, которые проявляются скоплением воздуха в грудной клетке, сопровождающиеся сдавлением лёгких и средостения (срединной области грудной клетки), подкожной эмфиземой. Наблюдается неадекватный ответ на бронхолитики. Обструктивные явления (непроходимость) затрагивают преимущественно верхние отделы респираторного тракта. [3]
Описаны характерные изменения на электрокардиограмме, включающие синдром раннего возбуждения желудочков, преждевременные желудочковые комплексы, нестабильность конечной части желудочкового комплекса в задненижних отведениях. [3]
Патология ритма чаще всего проявляются блокадой правой ножки пучка Гиса или смешанной экстрасистолией. [6]
У больных синдромом Марфана с патологией ритма сердечной деятельности и проводимости синдром вегетативной дисфункции чаще протекает по ваготоническому типу, в виде пресинкопальных, обморочных и астеновегетативных состояний, болезненных ощущений в области сердца, цефалгии напряжения (головной боли) и зачастую сочетается с психопатологическими расстройствами. [4]
Органы пищеварения также задействованы в патологическом процессе, что проявляется дискинезией (нарушением моторики) билиарного тракта со снижением моторики гладкомышечной мускулатуры, недостаточностью кардии, грыжевыми выпячиваниями пищеводного отверстия диафрагмы, аномалиями желчевыводящих протоков, долихосигмой (увеличением сигмовидной кишки), хроническим гастродуоденитом (воспалением слизистой желудка и двенадцатиперстной кишки), дисбиозом (нарушением нормальной микрофлоры) кишечника, изменениями поджелудочной железы. [3]
У пациентов с синдромом Марфана чаще, чем у здоровых людей, встречаются приобретённые аномалии почек: повышенная подвижность почек, нефроптоз (опущение почки), пиелоэктазии (аномальное расширение лоханок), повышена частота удвоения почек.
Патогенез синдрома Марфана
Более половины веса человека представлено соединительной тканью, из неё состоит наша главная опора — скелет, внешние покровы — кожа. Сосуды, кровь и лимфа тоже состоят из соединительной ткани.
К клеткам соединительной ткани относятся фибробласты и их разновидности (остеобласты, хондроциты, одонтобласты, кератобласты), макрофаги (гистиоциты) и тучные клетки (лаброциты). [7]
Мезенхима — проводник конституциональных, генетических и эпигенетических составляющих жизни человека. Патология соединительной ткани детерминирует определенное патологическое действие на весь организм в целом, на его физиологию и его конституциональные особенности. [3]
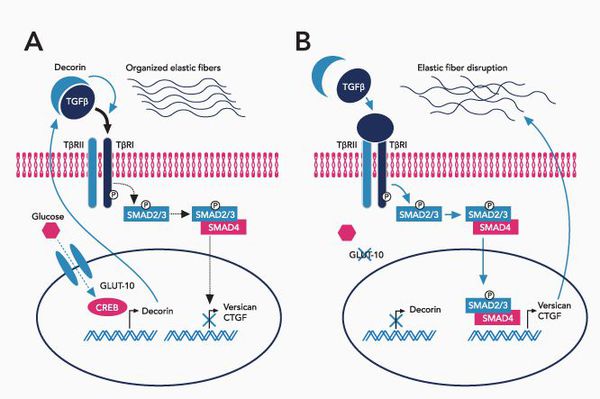
При болезни Марфана происходит замена нуклеотидов в гене, содержащем информацию о структуре пептида фибриллина-1. Этот белок относится к гликопротеидам, принимает участие в микрофибриллярном комплексе, он обеспечивает основу эластических фибрилл соединительной ткани.
Межклеточный матрикс позволяет соединительной ткани поддерживать постоянную структуру, в нём находится огромное количество факторов роста, которые обеспечивают постоянное обновление клеток.
В крупных сосудах, связочном аппарате содержится большое количество эластиновых фибрилл, поражение которых и даёт основные клинические проявления синдрома Марфана.
При синдроме Марфана значительно поражается трансформирующий фактор роста бета (TGF-β), нарушается связывание его неактивной формы, что приводит к повышению биоактивности данного фактора, с чем связано появление многих проявлений болезни. [4]
Патология фибриллина приводит к патологии формирования волокон, что вызывает утерю прочности и эластичности кожи и других соединительнотканных структур.
Изменение структуры коллагеновых волокон приводит к нарушению первичного звена гемостаза у пациентов с синдромом Марфана. [6]
Имеются данные о дефектах мембранных и цитоплазматических механизмов проведения сигнала непосредственно в самом тромбоците, приводящих к нарушениям агрегации (объединения). Показано наличие самостоятельного мембранного дефекта тромбоцитов, протекающего с нарушением реакций высвобождения и транспорта внутриклеточного кальция. [6]
Эластические фибриллы имеют вполне определенные механизмы участия в системе гемостаза. В сосудах с низкой скоростью сдвига происходит адгезия («прилипание») тромбоцитов к эластину через фибронектин. [7] Регистрируется снижение его уровня в крови у людей с синдромом Марфана. Фибронектин, в свою очередь, образуется в клетках эндотелия и участвует в последующих репаративных процессах, создавая основу для производства других компонентов соединительной ткани — фибробластов. [4] Таким образом, совершенно неоспоримо участие сосудистой стенки в реакциях свертываемости крови, и неизбежен вывод о возможных патологиях протекания нормальных гемостатических процессов при изменении состояния её структурных компонентов и процессов сосудистой регуляции.
Отмечена роль гормонального дисбаланса в развитии и усугублении дефектов соединительнотканных структур. [3]
Тромботические проявления детерминированы нарушением реологии (вязкости) крови в патологически извитых сосудах брахиоцефальной зоны. [3]
Поражение желудочно-кишечного тракта детерминировано тем, что эта система богата коллагеном. Наблюдаются дискинезия билиарного тракта по гипомоторному типу, грыжи пищеводного отверстия диафрагмы, аномалии желчных путей, долихосигма, хронический гастродуоденит со стёртой клинической картиной, склонностью к торпидному течению. [3]
Классификация и стадии развития синдрома Марфана
Код синдрома Марфана по Международной классификации болезней (МКБ-10): Q87.4.
Выделяют различные типы по степени тяжести:
Частота тяжёлых форм — 1 к 25000-50000 (при общей частоте диагностированных случаев 1 к 10000-15000).
По характеру течения:
Чаще всего первые признаки синдрома Марфана проявляются еще в детском периоде, с возрастом происходит прогрессирование симптомов, усиление клинических проявлений.
Осложнения синдрома Марфана
К самым частым осложнениям синдрома Марфана относятся:
Диагностика синдрома Марфана
Диагностика Синдрома Марфана основывается на клинических данных, выявлении изменений в гене FBN1. [5]
Часто при сборе генеалогического анамнеза выявляются родственные случаи со скрытым течением заболевания. [1]
Способы обнаружения арахнодактилии: [3]
В 2010 году группа специалистов систематизировала международные Гентские критерии для верификации синдрома Марфана. Верификация зависит от данных генеалогического анамнеза. [3]
При отсутствии генеалогического анамнеза:
При наличии генеалогического анамнеза:
В пятнадцати процентах появление ребёнка с синдромом Марфана спорадическое (случайное), у родителей могут быть слабые проявления. У родственников пациентов встречаются заболевания желудочно-кишечного тракта, поражения позвоночника, заболевания глаз. [3]
При малейшем подозрении на синдром Марфана необходима консультация офтальмолога. В анализе мочи таких пациентов отмечается повышение уровня оксипролина, гликозаминогликанов, но эти показатели низкоспецифичны, могут быть при различных дисплазиях соединительной ткани. Выделение оксипролина является показателем тяжести заболевания. Наблюдается нарушение свертываемости крови на тромбоцитарном уровне. [3]
Оценка системных признаков вовлечённости соединительной ткани