С чем взаимодействует оксид натрия
Оксид натрия, характеристика, свойства и получение, химические реакции
Оксид натрия, характеристика, свойства и получение, химические реакции.
Оксид натрия – неорганическое вещество, имеет химическую формулу Na2O.
Краткая характеристика оксида натрия:
Оксид натрия – неорганическое вещество бесцветного либо белого цвета.
Так как валентность натрия равна одному, то оксид натрия содержит один атом кислорода и два атома натрия.
Химическая формула оксида натрия Na2O.
Оксид натрия в воде не растворяется, а вступает в реакцию с ней. Не растворяется в этаноле, вступает с ним в реакцию.
Оксид натрия относится к опасным веществам. Это едкое вещество, особенно опасен при смешивании с водой.
Физические свойства оксида натрия:
| Наименование параметра: | Значение: |
| Химическая формула | Na2O |
| Синонимы и названия иностранном языке | sodium oxide (англ.) |
окись натрия (рус.)
Получение оксида натрия:
Оксид натрия получается в результате следующих химических реакций:
При реакции натрия с кислородом образуется смесь, состоящая из 20 % оксида натрия и 80 % пероксида натрия.
Затем пероксид натрия обогащают натрием.
Химические свойства оксида натрия. Химические реакции оксида натрия:
Химически активное вещество.
Химические свойства оксида натрия аналогичны свойствам оксидов других щелочных металлов. Поэтому для него характерны следующие химические реакции:
В результате реакции образуется пероксид натрия.
Оксид серы также является кислотным оксидом. В результате реакции образуется соответственно соль – в первом случае – сульфит натрия, во втором случае – сульфат натрия.
Оксид кремния также является кислотным оксидом. В результате реакции образуется соль – силикат натрия.
Оксид фосфора также является кислотным оксидом. В результате реакции образуется соль – ортофосфат натрия.
Аналогично проходят реакции оксида натрия и с другими кислотными оксидами.
Оксид алюминия является амфотерным оксидом. Это значит, что как амфотерный оксид оксид алюминия проявляет свойства как кислотных, так и основных соединений. В результате реакции образуется соль – алюминат натрия.
Аналогично проходят реакции оксида натрия и с другими амфотерными оксидами.
В результате реакции образуется соль – купрат натрия.
В результате реакции образуется соль – феррат натрия.
В результате реакции образуется соль – плюмбит натрия.
Аналогично проходят реакции оксида натрия и с другими оксидами.
В результате реакции образуются соль нитрит натрия.
В результате химической реакции получается соль – фторид натрия и вода.
Аналогично проходят реакции оксида натрия и с другими кислотами.
В результате химической реакции получается гидроксид натрия и амид натрия.
Оксид натрия в результате термического разложения разлагается на пероксид натрия и натрий.
Применение и использование оксида натрия:
Оксид натрия используется в качестве реактива для различных синтезов, для приготовления гидроксида натрия и других веществ.
Примечание: © Фото //www.pexels.com, //pixabay.com
оксид натрия реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие оксида натрия
реакции с оксидом натрия
Мировая экономика
Справочники
Востребованные технологии
Поиск технологий
О чём данный сайт?
Настоящий сайт посвящен авторским научным разработкам в области экономики и научной идее осуществления Второй индустриализации России.
Он включает в себя:
– экономику Второй индустриализации России,
– теорию, методологию и инструментарий инновационного развития – осуществления Второй индустриализации России,
– организационный механизм осуществления Второй индустриализации России,
– справочник прорывных технологий.
Мы не продаем товары, технологии и пр. производителей и изобретателей! Необходимо обращаться к ним напрямую!
Мы проводим переговоры с производителями и изобретателями отечественных прорывных технологий и даем рекомендации по их использованию.
О Второй индустриализации
Осуществление Второй индустриализации России базируется на качественно новой научной основе (теории, методологии и инструментарии), разработанной авторами сайта.
Конечным результатом Второй индустриализации России является повышение благосостояния каждого члена общества: рядового человека, предприятия и государства.
Вторая индустриализация России есть совокупность научно-технических и иных инновационных идей, проектов и разработок, имеющих возможность быть широко реализованными в практике хозяйственной деятельности в короткие сроки (3-5 лет), которые обеспечат качественно новое прогрессивное развитие общества в предстоящие 50-75 лет.
Та из стран, которая первой осуществит этот комплексный прорыв – Россия, станет лидером в мировом сообществе и останется недосягаемой для других стран на века.
Оксид натрия
Характеристики и физические свойства оксида натрия
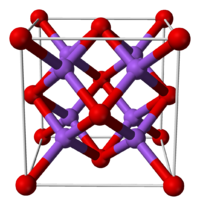
Оксид натрия имеет структуру антифлюорита. Эта структура родственна CaF2, однако катионы и анионы в ней меняются местами, так что атом натрия занимает место фтора, а кислород – кальция.
Рис. 1. Оксид натрия. Внешний вид.
Таблица 1. Физические свойства оксида натрия.
Плотность (20 o С), г/см 3
Температура плавления, o С
Температура кипения, o С
Получение оксида натрия
Оксид натрия синтезируют взаимодействием пероксида, гидроксида, а предпочтительнее всего нитрита натрия с металлическим натрием:
В последней реакции натрий можно заменить азидом NaN3, при этом образуются те же продукты.
Химические свойства оксида натрия
Оксид натрия проявляет сильные основные свойства. Он бурно реагирует с водой с образованием гидроксида натрия и выделением большого количества теплоты:
Оксид натрия реагирует с кислотами (1), кислотными (2, 3) и амфотерными оксидами (4), жидким аммиаком (5):
При нагревании до температуры выше 700 o С оксид натрия разлагается на пероксид натрия и натрий:
Применение оксида натрия
Основное направление использования оксида натрия – неорганический синтез: производство гидроксида натрия и других веществ.
Примеры решения задач
| Задание | Вычислите массу оксида натрия, который потребуется для получения карбоната натрия по реакции взаимодействия с диоксидом углерода массой 5,5 г. |
| Решение | Запишем уравнение реакции взаимодействия оксида натрия и диоксида углерода с образованием карбоната натрия: |
Рассчитаем количество вещества диоксида углерода (молярная масса – 44 г/моль):
n (CO2) = 5,5 / 44 = 0,125моль.
Найдем массу оксида натрия (молярная масса – 62 г/моль):
m (Na2O) = 0,125 × 62 = 7,75г.
| Задание | Вычислите массу оксида натрия, который потребуется для получения гидроксида натрия по реакции взаимодействия с водой массой 100 г. |
| Решение | Запишем уравнение реакции взаимодействия оксида натрия и воды с образованием гидроксида натрия: |
Рассчитаем количество вещества воды (молярная масса – 18 г/моль):
n (H2O) = 100 / 18 = 5,6 моль.
Найдем массу оксида натрия (молярная масса – 62 г/моль):
Оксид натрия
| Оксид натрия | |
|---|---|
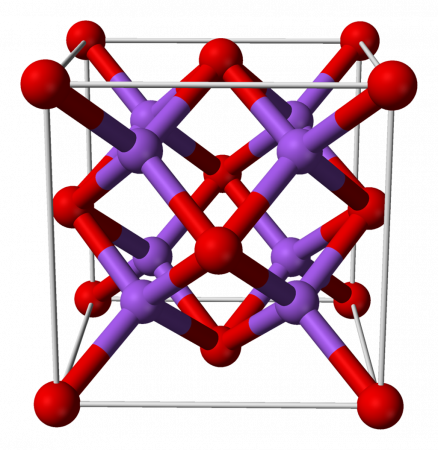 | |
| Систематическое наименование | Оксид натрия |
| Традиционные названия | Окись натрия |
| Хим. формула | Na2O |
| Рац. формула | Na2O |
| Состояние | твёрдое |
| Молярная масса | 61,979 г/моль |
| Плотность | 2,27 (20 °C) |
| Температура | |
| • плавления | 1132 °C |
| • кипения | 1950 °C |
| Энтальпия | |
| • образования | −416 кДж/моль |
| Рег. номер CAS | 1313-59-3 |
| PubChem | 73971 |
| Рег. номер EINECS | 215-208-9 |
| SMILES | |
| Номер ООН | 1825 |
| ChemSpider | 66599 |
| Пиктограммы ECB |  |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Оксид натрия — бинарное неорганическое вещество, имеющее формулу Na2O и относящееся к классу основных оксидов.
Содержание
Описание
Оксид натрия представляет собой бесцветные кристаллы кубической сингонии. Хранить оксид натрия Na2O лучше всего в безводном бензоле.
Получение
1. Взаимодействие металлического натрия с кислородом:
Чистый оксид натрия получить непосредственным окислением натрия нельзя, так как образуется смесь, состоящая из 20 % оксида натрия и 80 % пероксида натрия:
2. Взаимодействие металлического натрия с нитратом натрия:
3. Прокаливание пероксида натрия с избытком натрия:
Химические свойства
1. Взаимодействие с водой с образованием щёлочи:
2. Взаимодействие с кислотными оксидами с образованием соли:
3. Взаимодействие с кислотами с образованием соли и воды:
Na2O + 2 HCl ⟶ 2 NaCl + H2O
Применение
Оксид натрия применяется, в основном, в качестве реактива для различных синтезов, для приготовления гидроксида натрия и других веществ.
Оксид натрия
Окси́д на́трия — бинарное неорганическое вещество, имеющее формулу 
| Оксид натрия | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Оксид натрия |
| Традиционные названия | Окись натрия |
| Химическая формула | Na2O |
| Эмпирическая формула | Na2O |
| Физические свойства | |
| Состояние (ст. усл.) | твёрдое |
| Молярная масса | 61,979 г/моль |
| Плотность | 2,27 (20 °C) г/см³ |
| Термические свойства | |
| Температура плавления | 1132 °C |
| Температура кипения | 1950 °C |
| Энтальпия образования (ст. усл.) | -416 кДж/моль |
| Классификация | |
| Рег. номер CAS | 1313-59-3 |
| Номер ООН | 1825 |




















