С чем взаимодействует naoh уравнение реакции
Гидроксид натрия
Характеристики и физические свойства гидроксида натрия
Ввиду сильного разъедающего действия на ткани, кожу, бумагу и другие органические вещества он называется едким натром. В технике гидроксид натрия часто называют каустической содой.
В воде гидроксид натрия растворяется с выделением большого количества теплоты вследствие образования гидратов.
Гидроксид натрия следует хранить в хорошо закупоренных сосудах, так как он легко поглощает из воздуха диоксид углерода, постепенно превращаясь в карбонат натрия.
Рис. 1. Гидроксид натрия. Внешний вид.
Получение гидроксида натрия
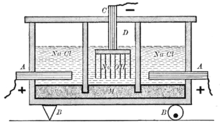
Основным способом получения гидроксида натрия является электролиз водного раствора хлорида натрия. В ходе электролиза на катоде разряжаются ионы водорода и одновременно вблизи катода накапливаются ионы натрия и гидроксид-ионы, т.е. получается гидроксид натрия; на аноде выделяется хлор.
Кроме электролитического способа получения гидроксида натрия, иногда еще применяют более старый способ – кипячение раствора соды с гашеной известью:
Химические свойства гидроксида натрия
Гидроксид натрия реагирует с кислотами с образованием солей и воды (реакция нейтрализации):
NaOH + HCl = NaCl + H2O;
Раствор гидроксида натрия изменяет цвет индикаторов, так, например, при добавлении лакмуса, фенолфталеина или метилового оранжевого в раствор этой щелочи их окраска станет синей, малиновой и желтой соответственно.
Гидроксид натрия реагирует с растворами солей (если в их состав входит металл, способный образовать нерастворимое основание) и кислотными оксидами:
Применение гидроксида натрия
Гидроксид натрия – один из важнейших продуктов основной химической промышленности. В больших количествах он потребляется для очистки продуктов переработки нефти; гидроксид натрия широко применяется в мыловаренной, бумажной, текстильной и других отраслях промышленности, а также при производстве искусственного волокна.
Примеры решения задач
| Задание | Вычислите массу гидроксида натрия, который может прореагировать с концентрированным раствором соляной кислоты объемом 300 мл (массовая доля HCl 34%, плотность 1,168 кг/л). |
| Решение | Запишем уравнение реакции: |
NaOH + HCl = NaCl + H2O.
Найдем массу раствора соляной кислоты, а также массу растворенного вещества HCl в нем:
msolution =0,3 × 1,168 = 0,3504 кг = 350,4г.
msolute (HCl) = ω (HCl) / 100% ×msolution;
msolute (HCl) = 34 / 100% × 350,4= 11,91 г.
Рассчитаем количество моль соляной кислоты (молярная масса равна 36,5 г/моль):
n(HCl) = m (HCl) / M (HCl);
n (HCl) = 11,91 / 36,5 = 0,34 моль.
Согласно уравнению реакции n (HCl) :n (NaOH) =1: 1. Значит,
n(NaOH) = n(HCl) = 0,34моль.
Тогда масса гидроксида натрия, вступившего в реакцию будет равна (молярная масса – 40 г/моль):
m (NaOH) = n (NaOH)× M (NaOH);
m (NaOH) = 0,34× 40 = 13,6г.
| Задание | Вычислите массу карбоната натрия, который потребуется для получения гидроксида натрия по реакции взаимодействия с гидроксидом кальция массой 3,5 г. |
| Решение | Запишем уравнение реакции взаимодействия карбоната натрия с гидроксидом кальция с образованием гидроксида натрия: |
Рассчитаем количество вещества гидроксида кальция (молярная масса – 74 г/моль):
n (Ca(OH)2) = 3,5 / 74 = 0,05моль.
Найдем массу карбоната натрия (молярная масса – 106 г/моль):
Гидроксид натрия
На воздухе во влажной среде окисляется образуя гидроксид натрия :
Все оксидные соединения натрия взаимодействуя с водой дают гидроксиды :
А реакция с горячей водой приводит к образованию только кислорода и гидроксида :
При комнатной температуре легко разлагается на кислород и гидроксид натрия :
А если используется катализатор типа оксид марганца получается только кислород и гидроксид натрия :
Реакция с кислотами дают соответствующие соли например с соляной кислотой :
NaOH + HCl = NaCl + H2O
Реакция с серной кислотой даёт сульфат натрия :
С концентрированной серной кислотой на холоду дает гидросульфат натрия :
С азотной кислотой получается нитрат натрия :
В зависимости от концентрации как гидроксида натрия так и от фосфорной кислоты получаются разные вещества :
С галогенами в зависимости от концентрации и температуры также образуются разные вещества :
NaOH( кон ) + HCN = NaCN + H2O
Реакция при ( 600 ) с щелочными металлами приводит к образованию оксида натрия и свободного водорода :
Реакции гидроксида натрия
4NaOH + 3Ca = ЗСаО + Na2O + 2Na + 2H2 (600° С).
2(NaOH·H2O) + 2Al = 2NaAlO2 + 3H2 (400-500° С),
2NaOH(конц.) + 6Н2О(гор.) + 2Аl = 2Na[Al(OH)4] + 3H2↑
2NaOH(конц.) + 2H2O + Zn = Na2[Zn(OH)4] + H2↑
NaOH(paзб.) + EO2 = NaHEO3 (Е = С, S), Где Е ( C углерод и S сера )
2NaOH(конц.) + EO2 = Na2EO3 + H2O.
4NaOH(конц.) + SiO2 → Na4SiO4 + 2H2O,
2NaOH + SiO2 = Na2SiO3 + H2O (900—1000°С).
4NaOH + 6NO = 4NaNO2 + N2 + 2H2O (300—400°С).
2NaOH(xoл.) + NO + NO2 = 2NaNO2 + H2O,
4NaOH(гop.) + 4NO2 + O2 = 4NaNO3 + 2H2O.
2NaOH + Al2O3 = 2NaAlO2 + H2O (900—1100°С),
NaOH + Al(OH)3 = NaAlO2 + 2H2O (1000°С).
2NaOH(конц., гор.) + 3H2O + Al2O3 = 2Na[Al(OH)4],
NaOH(конц.) + Al(OH)3 = Na[Al(OH)4].
2NaOH(60%-й) + H2O + ZnO = Na2[Zn(OH)4] (90°С),
2NaOH(конц.) + Zn(OH)2 = Na2[Zn(OH)4] (комн.).
NaOH(конц.) + NH4Cl(конц.) = NaCl + NH3↑ + H2O (кип.).
2NaOH(paзб.) + FeI2 = 2NaI + Fe(OH)2↓ (в атмосфере азота N2),
2NaOH(paзб.) + 2AgNO3 = Ag2O↓ + H2O + 2NaNO3.
3NaOH(paзб.) + AlCl3 = Al(OH)3↓ + 3NaCl,
4NaOH(конц.) + AlCl3 = Na[Al(OH)4] + 3NaCl.
2NaOH(paзб.) + ZnCl2 = Zn(OH)2↓ + 2NaCl,
4NaOH(конц.) + ZnCl2 = Na2[Zn(OH)4] + 2NaCl.
2NaOH(paзб., хол.) + Zn + 2SO2 = Na2S2O4 + Zn(OH)2↓.
2NaOH + 2H2O + ЗН2О2(конц.) = Na2O2·2H2O2·4H2O↓ (0°С),
Na2O2·2H2O2·4H2O = Na2O2 + 2H2O2 + 4H2O (комн., над конц. H2SO4).
Статья на тему гидроксид натрия
Похожие страницы:
Понравилась статья поделись ей
Гидроксид натрия, характеристика, свойства и получение, химические реакции
Гидроксид натрия, характеристика, свойства и получение, химические реакции.
Гидроксид натрия – неорганическое вещество, имеет химическую формулу NaOH.
Краткая характеристика гидроксида натрия:
Гидроксид натрия – неорганическое вещество белого цвета.
Химическая формула гидроксида натрия NaOН.
Обладает высокой гигроскопичностью. На воздухе «расплывается», активно поглощая пары воды из воздуха.
Хорошо растворяется в воде, при этом выделяя большое количество тепловой энергии. Раствор едкого натра мылок на ощупь.
Гидроксид натрия – самая распространённая щёлочь. В год в мире производится и потребляется около 57 миллионов тонн едкого натра.
Гидроксид натрия – едкое, токсическое и коррозионно-активное вещество. Оно относится к веществам второго класса опасности. Поэтому при работе с ним требуется соблюдать осторожность. При попадании на кожу, слизистые оболочки и в глаза образуются серьёзные химические ожоги.
Модификации гидроксида натрия:
До 299 о С гидроксид натрия имеет устойчивую ромбическую модификацию (a = 0,33994 нм, c = 1,1377 нм), выше 299 о С – моноклинную.
Физические свойства гидроксида натрия:
| Наименование параметра: | Значение: |
| Химическая формула | NaOН |
| Синонимы и названия иностранном языке | sodium hydroxide (англ.) |
натрия гидроокись (рус.)
сода каустическая (рус.)
Получение гидроксида натрия:
Гидроксид натрия получается в результате следующих химических реакций:
Пиролитический метод получения гидроксида натрия является наиболее древним и начинается с получения оксида натрия Na2О путём прокаливания карбоната натрия при температуре 1000 °C либо нагревания до 200 °C гидрокарбоната натрия в целях получения карбоната натрия:
2NaHCO3 → Na2CO3 + CO2 + H2O (t = 200 o C), после чего проводят первую химическую реакцию.
Полученный оксид натрия охлаждают и очень осторожно (реакция происходит с выделением большого количества тепла) добавляют в воду:
Карбонат кальция отделяется от раствора фильтрацией, затем раствор упаривается до получения расплавленного продукта, содержащего около 92 % масс. NaOH.
Реакционную смесь спекают.
Реакция протекает медленно.
Fe2O3•nH2O выпадает в осадок, который после отделения его от раствора возвращается в процесс в первую реакцию.
Одновременно получаются также водород и хлор.
Гидроксид натрия, водород и хлор вырабатываются тремя электрохимическими методами. Два из них – электролиз с твёрдым катодом (диафрагменный и мембранный методы), третий – электролиз с жидким ртутным катодом (ртутный метод).
Химические свойства гидроксида натрия. Химические реакции гидроксида натрия:
Гидроксид натрия – химически активное вещество, сильное химическое основание.
Водные растворы NaOH имеют сильную щелочную реакцию (pH 1%-раствора = 13,4).
Химические свойства гидроксида натрия аналогичны свойствам гидроксидов других щелочных металлов. Поэтому для него характерны следующие химические реакции:
1. реакция гидроксида натрия с серой:
В результате реакции образуются сульфид натрия, сульфит натрия и вода. При этом гидроксид натрия в качестве исходного вещества используется в виде разбавленного раствора.
2. реакция гидроксида натрия с хлором:
2NaOH + Cl2 → NaCl + NaClO + H2O.
В результате реакции образуются хлорид натрия, гипохлорит натрия и вода. При этом гидроксид натрия в качестве исходного вещества используется в виде холодного разбавленного раствора.
Аналогично проходят реакции гидроксида натрия и с другими галогенами.
3. реакция гидроксида натрия с алюминием:
2Al + 6NaOH → 2NaAlO2 + 3H2 + 2Na2O (t = 450 °C).
4. реакция гидроксида натрия с алюминием и водой:
В результате реакции образуются тетрагидроксоалюминат натрия и водород. При этом гидроксид натрия в качестве исходного вещества используется в виде концентрированного раствора.
5. реакция гидроксида натрия с цинком:
6. реакция гидроксида натрия с цинком и водой:
В результате реакции образуются тетрагидроксоцинкат натрия и водород. При этом гидроксид натрия в качестве исходного вещества используется в виде концентрированного раствора.
7. реакция гидроксида натрия с ортофосфорной кислотой:
8. реакция гидроксида натрия с азотной кислотой:
9. реакция гидроксида натрия с азотной кислотой:
Аналогично проходят реакции гидроксида натрия и с другими кислотами.
10. реакция гидроксида натрия с сероводородом:
11. реакция гидроксида натрия с фтороводородом:
HF + NaOH → NaF + H2O,
В результате реакции образуются в первом случае – фторид натрия и вода, во втором – гидрофторид натрия и вода. При этом гидроксид натрия и фтороводород в первом случае в качестве исходного вещества используются в виде разбавленного раствора, во втором случае фтороводород используется в виде в виде концентрированного раствора.
12. реакция гидроксида натрия с бромоводородом:
HBr + NaOH → NaBr + H2O.
В результате реакции образуются бромид натрия и вода. При этом гидроксид натрия и бромоводород в качестве исходного вещества используются в виде разбавленного раствора.
13. реакция гидроксида натрия с йодоводородом:
HI + NaOH → NaI + H2O.
В результате реакции образуются йодид натрия и вода. При этом гидроксид натрия в качестве исходного вещества используется в виде разбавленного раствора.
14. реакция гидроксида натрия с оксидом цинка:
Оксид цинка является амфотерным оксидом. В результате реакции образуются цинкат натрия и вода.
15. реакция гидроксида натрия с оксидом цинка и водой:
ZnO + NaOH + H2O → Na[Zn(OH)3] (t = 100 °C),
Оксид цинка является амфотерным оксидом. В результате реакции образуется в первом случае – тригидроксоцинкат натрия и вода, во втором случае – тетрагидроксоцинкат натрия. При этом гидроксид натрия в качестве исходного вещества используется в первом случае в виде 40 % разбавленного раствора, во втором – в виде 60 % разбавленного раствора.
16. реакция гидроксида натрия с оксидом алюминия:
Оксид алюминия является амфотерным оксидом. В результате реакции образуются алюминат натрия и вода.
17. реакция гидроксида натрия с оксидом алюминия и водой:
Оксид алюминия является амфотерным оксидом. В результате реакции образуется в первом случае – гексагидроксоалюминат натрия, во втором случае – тетрагидроксоалюминат натрия. При этом гидроксид натрия в качестве исходного вещества используется во втором случае в виде концентрированного горячего раствора.
18. реакция гидроксида натрия с оксидом железа:
Оксид железа является амфотерным оксидом. В результате реакции образуются феррит натрия и вода. Реакция происходит при сплавлении исходных веществ.
Аналогично проходят реакции гидроксида натрия и с другими амфотерными оксидами.
19. реакция гидроксида натрия с оксидом углерода ( углекислым газом ):
В результате реакции образуется гидрокарбонат натрия.
20. реакция гидроксида натрия с оксидом серы:
В результате реакции образуется гидросульфит натрия. При этом гидроксид натрия в качестве исходного вещества используется в виде разбавленного раствора.
21. реакция гидроксида натрия с оксидом кремния:
В результате реакции образуется в первом случае – силикат натрия и вода, во втором случае – ортосиликат натрия и вода. При этом гидроксид натрия в качестве исходного вещества используется во втором случае в виде концентрированного раствора.
22. реакция гидроксида натрия с гидроксидом алюминия:
Гидроксид алюминия является амфотерным основанием. В результате реакции образуются в первом случае – алюминат натрия и вода, во втором случае – тетрагидроксоалюминат натрия. При этом гидроксид натрия в качестве исходного вещества используется во втором случае в виде концентрированного раствора.
23. реакция гидроксида натрия с гидроксидом цинка:
Гидроксид цинка является амфотерным основанием. В результате реакции образуется тетрагидроксоцинкат натрия. При этом гидроксид натрия в качестве исходного вещества используется в виде концентрированного раствора.
24. реакция гидроксида натрия с гидроксидом железа:
Гидроксид железа является амфотерным основанием. В результате реакции образуется гексагидроксоферрат натрия.
Аналогично проходят реакции гидроксида натрия и с другими амфотерными гидроксидами.
25. реакция гидроксида натрия с сульфатом железа:
В результате реакции образуются гидроксид железа и сульфат натрия.
26. реакция гидроксида натрия с хлоридом меди:
В результате реакции образуются гидроксид меди и хлорид натрия. При этом гидроксид натрия в качестве исходного вещества используется в виде разбавленного раствора.
27. реакция гидроксида натрия с нитратом свинца:
В результате реакции образуются гидроксид свинца и нитрат натрия. При этом гидроксид натрия в качестве исходного вещества используется в виде разбавленного раствора.
28. реакция гидроксида натрия с хлоридом алюминия:
В результате реакции образуются гидроксид алюминия и хлорид натрия. При этом гидроксид натрия в качестве исходного вещества используется в виде разбавленного раствора.
Аналогично проходят реакции гидроксида натрия и с другими солями.
Применение и использование гидроксида натрия:
Гидроксид натрия используется во множестве отраслей промышленности и для бытовых нужд:
– для омыления жиров при производстве мыла, шампуня и других моющих средств;
– в химических отраслях промышленности – для нейтрализации кислот и кислотных оксидов, как реагент или катализатор в химических реакциях, в химическом анализе для титрования, для травления алюминия и в производстве чистых металлов, в нефтепереработке – для производства масел;
Для получения биодизеля к девяти массовым единицам растительного масла добавляется одна массовая единица спирта (то есть соблюдается соотношение 9:1), а также щелочной катализатор (NaOH). Полученный эфир (главным образом линолевой кислоты) отличается хорошей воспламеняемостью, обеспечиваемой высоким цетановым числом. Цетановое число – условная количественная характеристика самовоспламеняемости дизельныхтоплив в цилиндре двигателя (аналог октанового числа для бензинов). Если для минерального дизтоплива характерен показатель в 50-52 %, то метиловый эфир уже изначально соответствует 56-58 % цетана. Сырьём для производства биодизеля могут быть различные растительные масла: рапсовое, соевое и другие, кроме тех, в составе которых высокое содержание пальмитиновой кислоты (пальмовое масло). При его производстве в процессе этерификации также образуется глицерин который используется в пищевой, косметической и бумажной промышленности;
– в качестве агента для растворения засоров канализационных труб, в виде сухих гранул или в составе гелей. Гидроксид натрия дезагрегирует засор и способствует лёгкому продвижению его далее по трубе;
– в текстильной промышленности – для мерсеризации хлопка и шерсти. При кратковременной обработке едким натром с последующей промывкой волокно приобретает прочность и шелковистый блеск;
– в приготовлении пищи: для мытья и очистки фруктов и овощей от кожицы, в производстве шоколада и какао, напитков, мороженого, окрашивания карамели, для размягчения маслин и придания им чёрной окраски, при производстве хлебобулочных изделий. Зарегистрирован в качестве пищевой добавки E-524;
Гидроксид натрия
| Гидроксид натрия | ||||||||
 | ||||||||
 | ||||||||
| Общие | ||||||||
|---|---|---|---|---|---|---|---|---|
| Традиционные названия | едкий натр, каустик, каустическая сода, едкая щелочь | |||||||
| Химическая формула | NaOH | |||||||
| Физические свойства | ||||||||
| Молярная масса | 39,997 г/моль | |||||||
| Плотность | 1,59 г/см³ | |||||||
| Термические свойства | ||||||||
| Температура плавления | 323 °C | |||||||
| Температура кипения | 1403 °C | |||||||
| Химические свойства | ||||||||
| Растворимость в воде | 108,7 г/100 мл | |||||||
| Безопасность | ||||||||
| Токсичность | Ацетат уранила-цинка | |||||||
| Цвет осадка | белый | бледно-жёлтый | жёлто-зелёный | желто-зелёный | белый | белый | бледно-жёлтый | зеленовато-жёлтый |
Методы получения
Гидроксид натрия может получаться в промышленности химическими и электрохимическими методами.
Химические методы получения гидроксида натрия
К химическим методам получения гидроксида натрия относятся известковый и ферритный.
Химические методы получения гидроксида натрия имеют существенные недостатки: расходуется большое количество энергоносителей, получаемый едкий натр сильно загрязнен примесями.
В настоящее время эти методы почти полностью вытеснены электрохимическими методами производства.
Известковый метод
Известковый метод получения гидроксида натрия заключается во взаимодействии раствора соды с известковым молоком при температуре около 80°С. Этот процесс называется каустификацией; он проходит по реакции:
В результате реакции получается раствор гидроксида натрия и осадок карбоната кальция. Карбонат кальция отделяется от раствора, который упаривается до получения расплавленного продукта, содержащего около 92 % масс. NaOH. Затем NaOH плавят и разливают в железные барабаны, где он застывает.
Ферритный метод
Ферритный метод получения гидроксида натрия состоит из двух этапов:
Реакция 1 представляет собой процесс спекания кальцинированной соды с окисью железа при температуре 1100—1200°С. При этом образуется спек — феррит натрия и выделяется двуокись углерода. Далее спек обрабатывают (выщелачивают) водой по реакции 2; получается раствор гидроксида натрия и осадок Fe2O3*xH2О, который после отделения его от раствора возвращается в процесс. Получаемый раствор щелочи содержит около 400 г/л NaOH. Его упаривают до получения продукта, содержащего около 92 % масс. NaOH, а затем получают твердый продукт в виде гранул или хлопьев.
Электрохимические методы получения гидроксида натрия
Электрохимически гидроксид натрия получают электролизом растворов галита (минерала, состоящего в основном из поваренной соли NaCl) с одновременным получением водорода и хлора. Этот процесс можно представить суммарной формулой:
Едкая щёлочь и хлор вырабатываются тремя электрохимическими методами. Два из них — электролиз с твёрдым катодом (диафрагменный и мембранный методы), третий — электролиз с жидким ртутным катодом (ртутный метод).
В мировой производственной практике используются все три метода получения хлора и каустика с явной тенденцией к увеличению доли мембранного электролиза.
| Показатель на 1 тонну NaOH | Ртутный метод | Диафрагменный метод | Мембранный метод |
|---|---|---|---|
| Выход хлора % | 99 | 96 | 98,5 |
| Электроэнергия (кВт·ч) | 3 150 | 3 260 | 2 520 |
| Концентрация NaOH | 50 | 12 | 35 |
| Чистота хлора | 99,2 | 98 | 99,3 |
| Чистота водорода | 99,9 | 99,9 | 99,9 |
| Массовая доля O2 в хлоре, % | 0,1 | 1—2 | 0,3 |
| Массовая доля Cl − в NaOH, % | 0,003 | 1—1,2 | 0,005 |
В России приблизительно 35 % от всего выпускаемого каустика вырабатывается электролизом с ртутным катодом и 65 % — электролизом с твёрдым катодом (диафрагменный и мембранный методы).
Диафрагменный метод
Наиболее простым, из электрохимических методов, в плане организации процесса и конструкционных материалов для электролизера, является диафрагменный метод получения гидроксида натрия.
Раствор соли в диафрагменном электролизере непрерывно подается в анодное пространство и протекает через, как правило, нанесённую на стальную катодную сетку асбестовую диафрагму, в которую, иногда, добавляют небольшое количество полимерных волокон.
Во многих конструкциях электролизеров катод полностью погружен под слой анолита (электролита из анодного пространства), а выделяющийся на катодной сетке водород отводится из под катода при помощи газоотводных труб, не проникая через диафрагму в анодное пространство благодаря противотоку.
В качестве анода в диафрагменных электролизерах может использоваться графитовый или угольный электроды. На сегодня их в основном заменили титановые аноды с окисно-рутениево-титановым покрытием (аноды ОРТА) или другие малорасходуемые.
На следующей стадии электролитический щёлок упаривают и доводят содержание в нём NaOH до товарной концентрации 42—50 % масс. в соответствии со стандартом.
Поваренная соль, сульфат натрия и другие примеси при повышении их концентрации в растворе выше их предела растворимости выпадают в осадок. Раствор едкой щёлочи декантируют от осадка и передают в качестве готового продукта на склад или продолжают стадию упаривания для получения твёрдого продукта, с последующим плавлением, чешуированием или грануляцией.
Обратную, то есть кристаллизовавшуюся в осадок поваренную соль возвращают назад в процесс, приготавливая из неё так называемый обратный рассол. От неё, во избежание накапливания примесей в растворах, перед приготовлением обратного рассола отделяют примеси.
Убыль анолита восполняют добавкой свежего рассола, получаемого подземным выщелачиванием соляных пластов, минеральных рассолов типа бишофита, предварительно очищенного от примесей или растворением галита. Свежий рассол перед смешиванием его с обратным рассолом очищают от механических взвесей и значительной части ионов кальция и магния.
Полученный хлор отделяется от паров воды, компримируется и подаётся либо на производство хлорсодержащих продуктов, либо на сжижение.
Благодаря относительной простоте и дешевизне диафрагменный метод получения гидроксида натрия до сих пор широко используется в промышленности.
Мембранный метод
Мембранный метод производства гидроксида натрия наиболее энергоэффективен, однако сложен в организации и эксплуатации.
С точки зрения электрохимических процессов мембранный метод подобен диафрагменному, но анодное и катодное пространства полностью разделены непроницаемой для анионов катионообменной мембраной. Благодаря этому свойству становится возможным получение более чистых, чем в случае с диафрагменного метода, щелоков. Поэтому в мембранном электролизере, в отличие от диафрагменного, не один поток, а два.
В анодное пространство поступает, как и в диафрагменном методе, поток раствора соли. А в катодное — деионизированная вода. Из катодного пространства вытекает поток обедненного анолита, содержащего так же примеси гипохлорит- и хлорат-ионов и хлор, а из анодного — щелока и водород, практически не содержащие примесей и близкие к товарной концентрации, что уменьшает затраты энергии на их упаривание и очистку.
Щелочь, получаемая с помощью мембранного электролиза, практически не уступает по качеству получаемой при помощи метода с использованием ртутного катода и постепенно заменяет щелочь, получаемую ртутным методом.
Однако, питающий раствор соли (как свежий так и оборотный) и вода предварительно максимально очищается от любых примесей. Такая тщательная очистка определяется высокой стоимость полимерных катионообменных мембран и их уязвимость к примесям в питающем растворе.
Кроме того, ограниченная геометрическая форма а также низкая механическая прочность и термическая стойкость ионообменных мембран во многом определяют сравнительно сложные конструкции установок мембранного электролиза. По той же причине мембранные установки требуют наиболее сложных систем автоматического контроля и управления.
Ртутный метод с жидким катодом
В ряду электрохимических методов получения щелоков самым эффективным способом является электролиз с ртутным катодом. Щелока, полученные при электролизе с жидким ртутным катодом, значительно чище полученных диафрагменным способом (Для некоторых производств это критично. Например, в производстве искусственных волокон можно применять только высокочистый каустик.), а по сравнению с мембранным методом организация процесса при получении щелочи ртутным методом гораздо проще.
Установка для ртутного электролиза состоит из электролизёра, разлагателя амальгамы и ртутного насоса, объединённых между собой ртутепроводящими коммуникациями.
Катодом электролизёра служит поток ртути, прокачиваемой насосом. Аноды — графитовые, угольные или малоизнашивающиеся (ОРТА, ТДМА или другие). Вместе с ртутью через электролизёр непрерывно течёт поток питающего поваренной соли.
На аноде происходит окисление ионов хлора из электролита, и выделяется хлор:
Хлор и анолит отводится из электролизёра. Анолит, выходящий из электролизера, донасыщают свежим галитом, извлекают из него примеси, внесённые с ним, а также вымываемые из анодов и конструкционных материалов, и возвращают на электролиз. Перед донасыщением из анолита извлекают растворённый в нём хлор.
На катоде восстанавливаются ионы натрия, которые образуют слабый раствор натрия в ртути (амальгаму натрия):
Na + + е = Na 0 nNa + + nHg − = Na + Hg
Амальгама непрерывно перетекает из электролизёра в разлагатель амальгамы. В разлагатель также непрерывно подаётся высоко очищенная вода. В нём амальгама натрия в результате самопроизвольного химического процесса почти полностью разлагается водой с образованием ртути, раствора каустика и водорода:
Полученный таким образом раствор каустика, являющийся товарным продуктом, практически не содержит примесей. Ртуть почти полностью освобождается от натрия и возвращается в электролизер. Водород отводится на очистку.
Растущие требования к экологической безопасности производств и дороговизна металлической ртути ведут к постепенному вытеснению ртутного метода методами получения щелочи с твердым катодом, в особенности мембранным методом.
Лабораторные методы получения
В лаборатории гидроксид натрия иногда получают химическими способами, но чаще используется небольшой электролизер диафрагменного или мембранного типа.
Рынок каустической соды
Мировое производство натра едкого, 2005 год
| Производитель | Объём производства, млн.тонн | Доля в мировом производстве |
|---|---|---|
| DOW | 6.363 | 11.1 |
| Occidental Chemical Company | 2.552 | 4.4 |
| Formosa Plastics | 2.016 | 3.5 |
| PPG | 1.684 | 2.9 |
| Bayer | 1.507 | 2.6 |
| Solvay | 1.252 | 2.2 |
| Akzo Nobel | 1.157 | 2.0 |
| Tosoh | 1.110 | 1.9 |
| Arkema | 1.049 | 1.8 |
| Olin | 0.970 | 1.7 |
| Россия | 1.290 | 2.24 |
| Китай | 9.138 | 15.88 |
| Другие | 27.559 | 47,87 |
| Всего: | 57,541 | 100 |
В России согласно ГОСТ 2263-79 производятся следующие марки натра едкого:
ТР — твёрдый ртутный (чешуированный);
ТД — твёрдый диафрагменный (плавленый);
РР — раствор ртутный;
РХ — раствор химический;
РД — раствор диафрагменный.
| Наименование показателя | ТР ОКП 21 3211 0400 | ТД ОКП 21 3212 0200 | РР ОКП 21 3211 0100 | РХ 1 сорт ОКП 21 3221 0530 | РХ 2 сорт ОКП 21 3221 0540 | РД Высший сорт ОКП 21 3212 0320 | РД Первый сорт ОКП 21 3212 0330 |
|---|---|---|---|---|---|---|---|
| Внешний вид | Чешуированная масса белого цвета. Допускается слабая окраска | Плавленая масса белого цвета. Допускается слабая окраска | Бесцветная прозрачная жидкость | Бесцветная или окрашенная жидкость. Допускается выкристаллизованный осадок | Бесцветная или окрашенная жидкость. Допускается выкристаллизованный осадок | Бесцветная или окрашенная жидкость. Допускается выкристаллизованный осадок | Бесцветная или окрашенная жидкость. Допускается выкристаллизованный осадок |
| Массовая доля гидроксида натрия, %, не менее | 98,5 | 94,0 | 42,0 | 45,5 | 43,0 | 46,0 | 44,0 |
Показатели российского рынка жидкого натра едкого в 2005—2006 г.
| Наименование предприятия | 2005 г. тыс.тонн | 2006 г. тыс.тонн | доля в 2005 г.% | доля в 2006 г.% |
|---|---|---|---|---|
| ОАО «Каустик», Стерлитамак | 239 | 249 | 20 | 20 |
| ОАО «Каустик», Волгоград | 210 | 216 | 18 | 18 |
| ОАО «Саянскхимпласт» | 129 | 111 | 11 | 9 |
| ООО «Усольехимпром» | 84 | 99 | 7 | 8 |
| ОАО «Сибур-Нефтехим» | 87 | 92 | 7 | 8 |
| ОАО «Химпром», Чебоксары | 82 | 92 | 7 | 8 |
| ВОАО «Химпром», Волгоград | 87 | 90 | 7 | 7 |
| ЗАО «Илимхимпром» | 70 | 84 | 6 | 7 |
| ОАО «КЧХК» | 81 | 79 | 7 | 6 |
| НАК «АЗОТ» | 73 | 61 | 6 | 5 |
| ОАО «Химпром», Кемерово | 42 | 44 | 4 | 4 |
| Итого: | 1184 | 1217 | 100 | 100 |
Показатели российского рынка твердого натра едкого в 2005—2006 г.
| Наименование предприятия | 2005 г. тонн | 2006 г. тонн | доля в 2005 г.% | доля в 2006 г.% |
|---|---|---|---|---|
| ОАО «Каустик», Волгоград | 67504 | 63510 | 62 | 60 |
| ОАО «Каустик», Стерлитамак | 34105 | 34761 | 31 | 33 |
| ОАО «Сибур-Нефтехим» | 1279 | 833 | 1 | 1 |
| ВОАО «Химпром», Волгоград | 5768 | 7115 | 5 | 7 |
| Итого: | 108565 | 106219 | 100 | 100 |
Применение
Едкий натр применяется во множестве отраслей промышленности и для бытовых нужд: