С чем взаимодействует hbr
Соединения брома
Бромоводород (НBr)
Способы получения бромоводорода
Химические свойства бромоводорода
НВr по физическим и химическим свойствам сходен с HCl, однако молекула НВr менее устойчива, чем HCl.
Восстановительные свойства галогеноводородов усиливаются в ряду HF – HCl – HBr – HI.
Кислородные кислоты и окислы брома
Бромноватистая кислота (HBrO)
HBrO — слабая неустойчивая кислота. В свободном виде не выделена. Максимально полученная концентрация HBrO в водном растворе — 30 %.
Ее соли и сложные эфиры называют гипобромитами.
Получение бромноватистой кислоты
HBrO получается при диспропорционировании брома в воде. Присутствие оксида ртути (II) смещает равновесие в сторону кислоты:
В полученном растворе концентрация бромноватистой кислоты не более 6 %.
Химические свойства бромноватистой кислоты
В темноте также при нагревании выше 60ºС:
3HBrO = HBrO3 + 2HBr
HBrO + NaOH = NaBrO + H2O
Бромистая кислота (HBrO2)
Бромистая кислота HBrO2 —неустойчивое соединение, существует только в водных растворах. Разлагается в течение 4 часов.
Образует соли — бромиты, например бромит бария Ba(BrO2)2•H2O.
Бромноватая кислота (HBrO3)
Бромноватая кислота HBrO3 — бесцветная (или слегка желтоватая) жидкость. В свободном состоянии не выделена, существует в растворе с максимальной концентрацией до 50%. Является сильной кислотой.
Получение бромноватой кислоты
Химические свойства бромноватой кислоты
Cоли бромноватой кислоты – броматы
Наиболее важными являются броматы калия и натрия – это белые вещества, хорошо растворимые в воде. Являются окислителями и слабыми восстановителями
Получение броматов
Химические свойства броматов
Бромная кислота (HBrO4)
Бромная кислота HBrO4 — сильная кислота. Cуществует только в водном растворе с максимальной концентрацией 83%. В свободном виде не выделена, устойчива в растворе с концентрацией менее 55%.
Соли кислоты — перброматы.
Получение бромной кислоты
NaBrO3 + F2 + 2NaOH = NaBrO4 + 2NaF + H2O
Химические свойства бромной кислоты
Соли бромной кислоты – перброматы
Наиболее выжный – пербромат калия. Белое вещество, умеренно растворимое в воде.
Получение перброматов
Химические свойства перброматов
Оксиды брома
Известны оксиды брома — Вr2O, ВrO2 и Вr3O8, которые крайне неустойчивы.
Ни одно из кислородных соединений брома не нашло важного практического применения
Бромистоводородная кислота — опасный, но важный химический реактив
Бромистоводородная кислота — сильная неорганическая кислота, ее формула HBr. 
В промышленных масштабах вещество получают химической реакцией водорода и брома в процессе нагревания, а так же как побочный продукт органического синтеза бромосодержащих соединений.
Свойства
Кислота хорошо растворяется в воде, спиртовой раствор образует электролит. Термически устойчива, даже при нагревании до 1000 °С на водород и бром разлагается не более полпроцента молекул вещества.
Водный раствор HBr — прозрачная бесцветная или слегка желтоватая жидкость. Желтый цвет раствору придают молекулы Br, образующиеся в процессе реакции вещества с кислородом воздуха. Реактив тяжелее воды, с резким запахом. С точки зрения химии — это одноосновная кислота с восстановительными свойствами. Считается одной из самых сильных кислот, по своей активности сопоставима с соляной кислотой. Реагирует с металлами, оксидами и щелочами с образованием бромидов. В реакции с металлами выделяет водород, который может воспламениться. Бромистоводородная кислота разрушает большинство металлов. Ее смесь с азотной кислотой способна растворять золото и платину.
Меры безопасности

Гост 2062-77 требует, чтобы работы с бромоводородом велись с использованием средств защиты лица, глаз, тела, органов дыхания, в вытяжном шкафу, с учетом правил противопожарной безопасности. Для нейтрализации пролитого реактива используют 10% раствор щелочи или большое количество воды. Для осаждения паров разлитой кислоты разбрызгивают воду. Газ тяжелее воздуха, поэтому при аварийных выбросах скапливается в нижней части помещения, в подвалах, в низинах.
HBr допускается перевозить любым транспортом с соответствующей маркировкой тары знаком опасности по ГОСТ 19433. Газообразная кислота транспортируется в баллонах под давлением 24 атм. Наиболее подходящая тара для хранения водной кислоты — пластиковые канистры.
Применение
— Бромистоводородная кислота, ее газообразная форма и водные растворы разной 
— Реактив используется как катализатор в реакциях алкилирования в органическом синтезе.
— Бромоводород востребован в аналитической химии и микробиологии, в нефтяной и химической индустрии.
В интернет-магазине реактивов и химического оборудования «ПраймКемикалс Групп» можно купить как бромистоводородную кислоту, так и пластиковую и стеклянную тару для нее, а также средства защиты для работы с агрессивными веществами.
Бромистоводородная кислота (HBr) структура, свойства, образование, использование
В химических уравнениях он должен быть записан как HBr (ac), чтобы указать, что это бромистоводородная кислота, а не газ. Эта кислота является одной из самых сильных, даже больше, чем соляная кислота, HCl. Объяснение этому кроется в природе его ковалентной связи.
Почему HBr такая кислота и еще больше растворяется в воде? Поскольку ковалентная связь H-Br очень слабая, из-за плохого перекрытия 1s-орбиталей H и 4p Br.
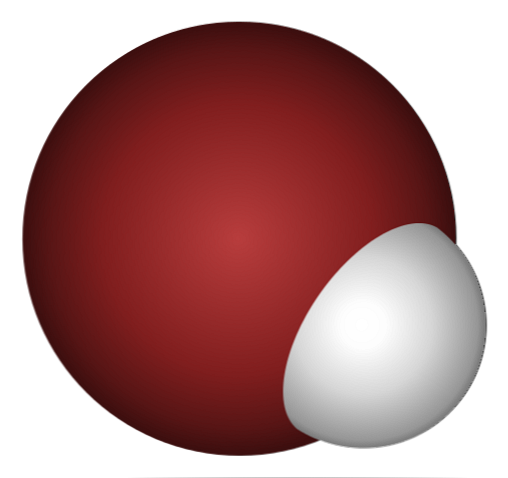
Это неудивительно, если вы внимательно посмотрите на изображение выше, где атом брома (коричневый) явно больше, чем атом водорода (белый).
Бромистоводородная кислота, после HI, является одним из самых сильных и полезных гидроцидов для расщепления определенных твердых образцов..
Структура бромистоводородной кислоты
На изображении показана структура H-Br, свойства и характеристики которого, даже газа, тесно связаны с его водными растворами. Вот почему наступает момент, когда вы вступаете в заблуждение относительно того, на какое из двух соединений намекают: HBr или HBr (ac).
Структура HBr (ac) отличается от структуры HBr, потому что теперь молекулы воды сольватируют эту двухатомную молекулу. Когда это достаточно близко, H передается + к молекуле Н2Или как указано в следующем химическом уравнении:
кислотность
Физико-химические свойства
Молекулярная формула
Молекулярный вес
Внешний вид
Бесцветная или бледно-желтая жидкость, которая будет зависеть от концентрации растворенного HBr. Чем оно более желтое, тем более концентрированным и опасным оно будет.
запах
Порог запаха
плотность
1,49 г / см 3 (водный раствор при 48% мас. / мас.). Эта величина, как и те, которые соответствуют точкам плавления и кипения, зависит от количества HBr, растворенного в воде.
Точка плавления
-11ºC (12ºF, 393ºK) (водный раствор при 49% мас. / Мас.).
Точка кипения
122 ° С (252 ° F, 393 ° К) при 700 мм рт. Ст. (Водный раствор 47-49% мас. / Мас.).
Растворимость в воде
-221 г / 100 мл (при 0 ºC).
-204 г / 100 мл (15 ºC).
-130 г / 100 мл (100 ºC).
Эти значения относятся к газообразному HBr, а не к бромистоводородной кислоте. Как видно, повышение температуры снижает растворимость HBr; поведение, которое является естественным в газах. Следовательно, если требуются концентрированные растворы HBr (ac), лучше работать с ними при низких температурах..
При работе при высоких температурах HBr будет выходить в виде газообразных двухатомных молекул, поэтому реактор должен быть герметично закрыт для предотвращения утечки.
Плотность пара
2,71 (по отношению к воздуху = 1).
Кислотность пКа
-9,0. Эта константа, столь отрицательная, свидетельствует о ее сильной кислотности.
Калорийность
Стандартная молярная энтальпия
198,7 кДж / моль (298 ºK).
Стандартная молярная энтропия
Точка зажигания
номенклатура
В то время как HBr (г), бромистый водород, является безводным; то есть у него нет воды. Поэтому он назван в соответствии с другими стандартами номенклатуры, что соответствует галогеноводородам.
Как это формируется?
Существует несколько синтетических методов приготовления бромистоводородной кислоты. Некоторые из них:
Смесь водорода и брома в воде
Без описания технических подробностей эту кислоту можно получить из прямой смеси водорода и брома в реакторе, заполненном водой..
Фосфор трибромид
В более сложном процессе смешивают песок, гидратированный красный фосфор и бром. Водяные ловушки помещаются в ледяные ванны, чтобы предотвратить выход HBr и образование вместо него бромистоводородной кислоты. Реакции:
Диоксид серы и брома
Это окислительно-восстановительная реакция. Br2 он уменьшает, он получает электроны, связываясь с атомами водорода; в то время как ТАК2 он окисляется, он теряет электроны, когда он образует больше ковалентных связей с другими атомами кислорода, как в серной кислоте.
приложений
Приготовление бромидов
Бромидные соли могут быть получены, если HBr (ac) реагирует с гидроксидом металла. Например, производство бромида кальция считается:
Другой пример для бромида натрия:
NaOH + HBr => NaBr + H2О
Таким образом, многие из неорганических бромидов могут быть получены.
Синтез алкилгалогенидов
А как насчет органических бромидов? Это броморганические соединения: RBr или ArBr.
Обезвоживание спиртов
Сырьем для их получения могут быть спирты. При протонировании кислотностью HBr они образуют воду, которая является хорошей исходящей группой, и вместо этого включается объемный атом Br, который становится ковалентно связанным с углеродом:
ROH + HBr => RBr + H2О
Добавление к алкенам и алкинам
Молекула HBr может быть добавлена из ее водного раствора к двойной или тройной связи алкена или алкина:
RC≡CR + HBr => RHC = CRBr
Можно получить несколько продуктов, но в простых условиях продукт сначала образуется там, где бром связан с вторичным, третичным или четвертичным углеродом (правило Марковникова)..
Эти галогениды вмешиваются в синтез других органических соединений, и диапазон их применения очень широк. Кроме того, некоторые из них могут даже использоваться в синтезе или разработке новых лекарств..
Эфирный кливаж
Из простых эфиров можно получить два алкилгалогенида одновременно, каждый из которых несет одну из двух боковых цепей R или R ‘исходного эфира R-O-R’. Случается что-то похожее на обезвоживание спиртов, но механизм его реакции другой.
Реакция может быть схематизирована с помощью следующего химического уравнения:
ROR ‘+ 2HBr => RBr + R’Br
И вода тоже выделяется.
катализатор
Бромистоводородная кислота (HBr): строение, свойства, образование
Содержание:
В химических уравнениях это должно быть записано как HBr (ac), что означает, что это бромистоводородная кислота, а не газ. Эта кислота является одной из самых сильных известных, даже в большей степени, чем соляная кислота, HCl. Объяснение этому кроется в природе их ковалентной связи.
Почему HBr такая сильная кислота, и тем более растворенная в воде? Потому что ковалентная связь H-Br очень слабая из-за плохого перекрытия 1s-орбиталей H и 4p Br.
Это неудивительно, если вы внимательно посмотрите на изображение выше, где ясно, что атом брома (коричневый) намного больше атома водорода (белый).
Бромистоводородная кислота после иодистоводородной HI является одной из самых сильных и наиболее полезных гидрокислот для разложения определенных твердых образцов.
Структура бромистоводородной кислоты
На изображении показана структура H-Br, свойства и характеристики которого, даже газа, тесно связаны с его водными растворами. Вот почему наступает момент, когда возникает путаница в отношении того, какое из двух соединений относится к HBr или HBr (ac).
Структура HBr (ac) отличается от структуры HBr, поскольку теперь молекулы воды растворяют эту двухатомную молекулу. Когда он достаточно близок, H передается + к молекуле H2Или как указано в следующем химическом уравнении:
Таким образом, структура бромистоводородной кислоты состоит из ионов Br - и H3ИЛИ + взаимодействуют электростатически. Теперь это немного отличается от ковалентной связи H-Br.
Кислотность
Физические и химические свойства
Молекулярная формула
Молекулярный вес
80,972 г / моль. Обратите внимание, что, как упоминалось в предыдущем разделе, рассматривается только HBr, а не молекула воды. Если бы молекулярную массу брали из формулы Br – ЧАС3ИЛИ + оно будет иметь значение приблизительно 99 г / моль.
Внешность
Бесцветная или бледно-желтая жидкость, которая будет зависеть от концентрации растворенного HBr. Чем больше он желтого цвета, тем он более концентрированный и опасный.
Запах
Порог запаха
Плотность
1,49 г / см 3 (48% водный раствор). Это значение, а также значения точек плавления и кипения зависят от количества HBr, растворенного в воде.
Температура плавления
-11 ° C (12 ° F, 393 ° K) (49% водный раствор).
Точка кипения
122 ° C (252 ° F 393 ° K) при 700 мм рт. Ст. (47-49% водный раствор).
Растворимость воды
-221 г / 100 мл (при 0 ° С).
-204 г / 100 мл (15 ° C).
-130 г / 100 мл (100 ° C).
Эти значения относятся к газообразному HBr, а не к бромистоводородной кислоте. Как видно, повышение температуры снижает растворимость HBr; поведение, естественное для газов. Следовательно, если требуются концентрированные растворы HBr (водн.), С ними лучше работать при низких температурах.
При работе при высоких температурах HBr улетучивается в виде двухатомных газообразных молекул, поэтому реактор должен быть герметизирован, чтобы предотвратить его утечку.
Плотность паров
2,71 (относительно воздуха = 1).
Кислотность pKa
-9,0. Эта отрицательная константа указывает на его высокую кислотность.
Калорийность
Стандартная молярная энтальпия
198,7 кДж / моль (298 К).
Стандартная молярная энтропия
точка воспламенения
Номенклатура
Принимая во внимание, что HBr (г), бромистый водород, является безводным; то есть в нем нет воды. Поэтому он назван в соответствии с другими стандартами номенклатуры, соответствующими галогенидам водорода.
Как он образуется?
Существует несколько синтетических методов получения бромистоводородной кислоты. Некоторые из них:
Смесь водорода и брома в воде
Без описания технических деталей, эта кислота может быть получена путем прямого смешивания водорода и брома в реакторе, заполненном водой.
Трибромид фосфора
В более сложном процессе смешивают песок, гидратированный красный фосфор и бром. Водные ловушки помещают в ледяные ванны, чтобы предотвратить утечку HBr и образование вместо этого бромистоводородной кислоты. Реакции следующие:
Диоксид серы и бром
Это окислительно-восстановительная реакция. BR2 уменьшает, получает электроны, связываясь с атомами водорода; в то время как SO2 он окисляется, теряет электроны, когда образует более ковалентные связи с другими атомами кислорода, как в серной кислоте.
Приложения
Подготовка бромида
Бромидные соли можно получить реакцией HBr (водн.) С гидроксидом металла. Например, считается производство бромида кальция:
Другой пример для бромида натрия:
NaOH + HBr => NaBr + H2ИЛИ
Таким образом, можно получить многие неорганические бромиды.
Синтез алкилгалогенидов
А как насчет органических бромидов? Это броморганические соединения: RBr или ArBr.
Обезвоживание алкоголя
Сырьем для их получения могут быть спирты. Когда они протонируются кислотностью HBr, они образуют воду, которая является хорошей уходящей группой, и на ее место включается объемный атом Br, который становится ковалентно связанным с углеродом:
ROH + HBr => RBr + H2ИЛИ
Дополнение к алкенам и алкинам
Молекула HBr может быть добавлена из водного раствора по двойной или тройной связи алкена или алкина:
RC≡CR + HBr => RHC = CRBr
Можно получить несколько продуктов, но в простых условиях образуется продукт, в котором бром связан с вторичным, третичным или четвертичным углеродом (правило Марковникова).
Эти галогениды участвуют в синтезе других органических соединений, и диапазон их использования очень обширен. Точно так же некоторые из них могут даже использоваться при синтезе или разработке новых лекарств.
Расщепление эфиров
Из простых эфиров могут быть получены одновременно два алкилгалогенида, каждый из которых несет одну из двух боковых цепей R или R ‘исходного эфира R-O-R’. Происходит нечто похожее на обезвоживание спиртов, но механизм их реакции другой.
Реакцию можно описать с помощью следующего химического уравнения:
ROR ‘+ 2HBr => RBr + R’Br
И вода тоже выделяется.
Катализатор
Его кислотность такова, что его можно использовать в качестве эффективного кислотного катализатора. Вместо добавления аниона Br – молекулярной структуре, это уступает место другой молекуле.
Ссылки
Нуклеофильный: нуклеофильная атака, типы, примеры, нуклеофильность
Лизоцим: характеристика, структура, функции
Бромоводород
Бромоводород (HBr) — соединение брома с водородом. Бесцветный тяжёлый токсичный газ, образует туман в сыром воздухе.
Содержание
Получение
В промышленности бромоводород получают непосредственным взаимодействием простых веществ:
Также бромистый водород получается как побочный продукт при синтезе бромпроизводных органических соединений
В лаборатории получают гидролизом трибромида или пентабромида фосфора:
Восстановление брома несколькими способами:
Вытеснение из бромидов щелочных металлов разбавленной кислотой:
Физические свойства
Хорошо растворим в воде: 221 г/100 г воды при 0 °C (193 при 25°, 130 при 100 °C). Водный раствор образует азеотропную смесь с 47,63 % HBr, которая кипит при 124,3 °C.
Растворяется в этаноле, образуя слабый электролит.
При охлаждении водных растворов HBr можно получить кристаллогидраты:
Чистый HBr образует кристаллы орторомбической сингонии, пространственная группа F mmm, параметры при −173 °C a = 0,5640 нм, b = 0,6063 нм, c = 0,5555 нм, Z = 4.
Химические свойства
Водный раствор бромистого водорода образует сильную одноосновную кислоту:
Термически HBr очень устойчив, при температуре 1000 °C разлагаются около 0,5 % молекул:
Как кислота реагирует с металлами, их оксидами, основаниями:
Является восстановителем, медленно окисляется на воздухе, из-за чего водные растворы со временем окрашиваются в бурый цвет:
Применение
Применяют для приготовления бромидов, синтеза различных органических бромпроизводных и для реактивного ионного травления.
Транспортировка
Безводный HBr транспортируют в баллонах ёмкостью 6,8 и 68 кг под давлением 24 атм.
Токсичность
Бромистый водород — едкое, весьма токсичное вещество, обладающее удушающим действием. Предельно допустимая концентрация = 10 мг/м³, поражающая токсодоза = 2,4 мг/л·мин.