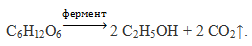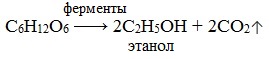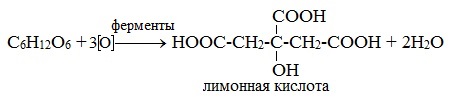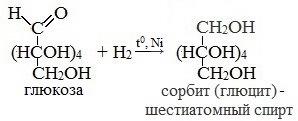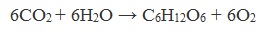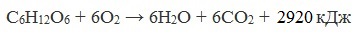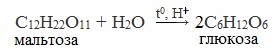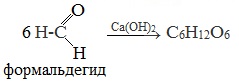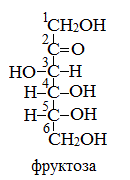С чем взаимодействует глюкоза
Глюкоза
Характеристики и физические свойства глюкозы
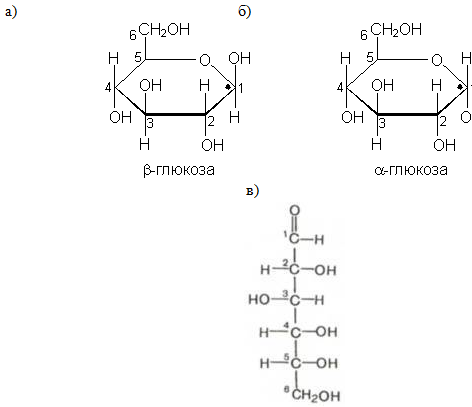
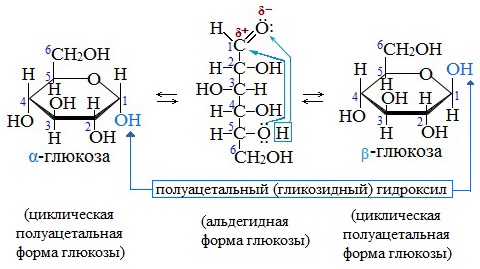
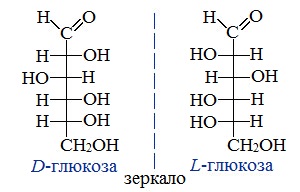
Молекулы глюкозы могут существовать в линейной (альдегидоспирт с пятью гидроксильными группами) и циклической форме (α- и β-глюкоза), причем вторая форма получается из первой при взаимодействии гидроксильной группы при 5-м атоме углерода с карбонильной группой (рис. 1).
Рис. 1. Формы существования глюкозы: а) β-глюкоза; б) α-глюкоза; в) линейная форма
Получение глюкозы
В промышленности глюкозу получают гидролизом полисахаридов – крахмала и целлюлозы:
Химические свойства глюкозы
Для глюкозы характерны следующие химические свойства:
1) Реакции, протекающие при участии карбонильной группы:
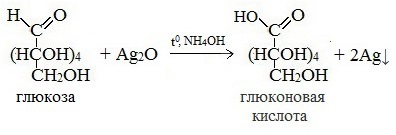
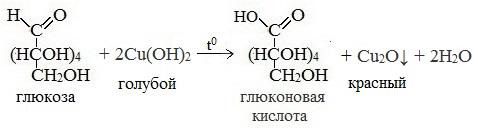
— глюкоза окисляется аммиачным раствором оксида серебра (1) и гидроксидом меди (II) (2) в глюконовую кислоту при нагревании
— глюкоза способна восстанавливаться в шестиатомный спирт – сорбит
— глюкоза не вступает в некоторые реакции, характерные для альдегидов, например, в реакцию с гидросульфитом натрия.
2) Реакции, протекающие при участии гидроксильных групп:
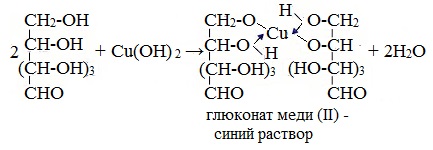
— глюкоза дает синее окрашивание с гидроксидом меди (II) (качественная реакция на многоатомные спирты);
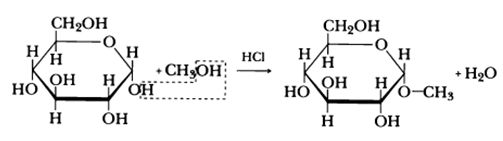
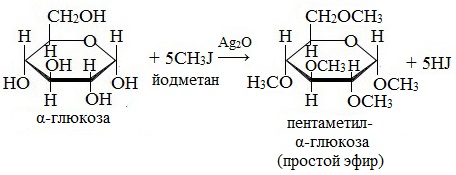
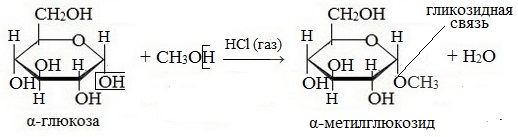
— образование простых эфиров. При действии метилового спирта на один из атомов водорода замещается на группу СН3. В эту реакцию вступает гликозидный гидроксил, находящийся при первом атоме углерода в циклической форме глюкозы
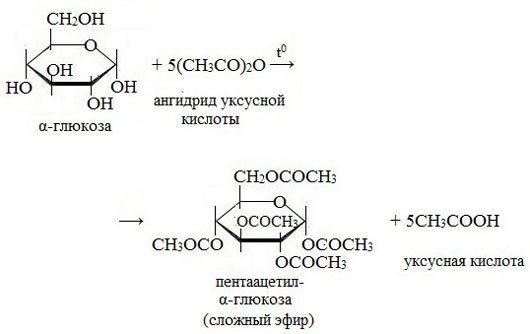
— образование сложных эфиров. Под действием уксусного ангидрида все пять групп –ОН в молекуле глюкозы замещаются на группу –О-СО-СН3.
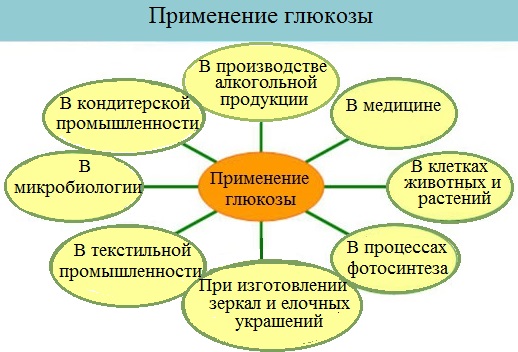
Применение глюкозы
Глюкоза находит широкое применение в текстильной промышленности при крашении и печатании рисунков; изготовлении зеркал и елочных украшений; в пищевой промышленности; в микробиологической промышленности как питательная среда для получения кормовых дрожжей; в медицине при самых разнообразных заболеваниях, особенно при истощении организма.
Примеры решения задач
| Задание | Составьте уравнения реакций между глюкозой и следующими веществами: а) водородом (в присутствии катализатора); б) азотной кислотой; в) аммиачным раствором оксида серебра. При каких условиях протекают эти реакции? |
| Ответ | При взаимодействии глюкозы с водородом в присутствии катализатора (обычно никель) и при нагревании происходит её восстановление. Продуктом этой реакции является шестиатомный спирт – сорбит, который применяется в качестве заменителя сахара: |
Качественной реакцией на альдегидную группу является реакция «серебряного зеркала» (глюкоза представляет собой альдегидоспирт) в результате чего выделяется серебро в чистом виде и образуется карбоновая кислота:
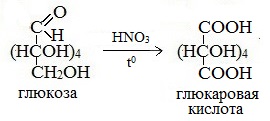
Окисление глюкозы в жестких условиях, например, концентрированной азотной кислотой, приводит к образованию глюкаровой кислоты:
| Задание | Рассчитайте объем оксида углерода (IV), приведенный к нормальным условиям, который выделится при спиртовом брожении 225 г глюкозы. |
| Решение | Запишем уравнение реакции спиртового брожения глюкозы: |
Рассчитаем количество вещества глюкозы:
M(C6H12O6) = 2×Ar(C) + 12×Ar(H) + 6×Ar(O) = 2×12 + 12×1 + 6×16 = 180г/моль;
Согласно уравнению реакции n(C6H12O6) : n(CO2) = 1 : 2, значит
Найдем объем выделившегося углекислого газа:
С чем взаимодействует глюкоза
Химические свойства глюкозы, как и других альдоз, обусловлены присутствием в ее молекуле: а)альдегидной группы; б) спиртовых гидроксилов; в) полуацетального (гликозидного) гидроксила.
Специфические свойства
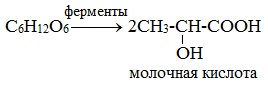
1. Брожение (ферментация) моносахаридов
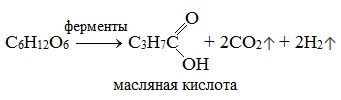
Важнейшим свойством моносахаридов является их ферментативное брожение, т.е. распад молекул на осколки под действием различных ферментов. Брожению подвергаются в основном гексозы в присутствии ферментов, выделяемых дрожжевыми грибками, бактериями или плесневыми грибками. В зависимости от природы действующего фермента различают реакции следующих видов:
1) Спиртовое брожение
2) Молочнокислое брожение
3) Маслянокислое брожение
4) Лимоннокислое брожение
Реакции с участием альдегидной группы глюкозы (свойства глюкозы как альдегида)
1. Восстановление (гидрирование) с образованием многоатомного спирта
В ходе этой реакции карбонильная группа восстанавливается и образуется новая спиртовая группа:
Cорбит содержится во многих ягодах и фруктах, особенно много сорбита в плодах рябины.
2. Окисление
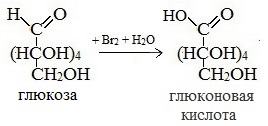
1) Окисление бромной водой
Качественные реакции на глюкозу как альдегид!
Протекающие в щелочной среде при нагревании реакции с аммиачным раствором Ag2O (реакция серебряного зеркала») и с гидроксидом меди (II) Cu (OH)2 приводят к образованию смеси продуктов окисления глюкозы.
2) Реакция серебряного зеркала
Соль этой кислоты – глюконат кальция – известное лекарственное средство.
Видеоопыт «Качественная реакция глюкозы с аммиачным раствором оксида серебра (I)»
3) Окисление гидроксидом меди (II)
В ходе этих реакций альдегидная группа – СНО окисляется до карбоксильной группы – СООН.
Реакции глюкозы с участием гидроксильных групп (свойства глюкозы как многоатомного спирта)
1. Взаимодействие с Cu (ОН)2 с образованием глюконата меди (II)
Качественная реакция на глюкозу как многоатомный спирт!
Подобно этиленгликолю и глицерину, глюкоза способна растворять гидроксид меди (II), образуя растворимое комплексное соединение синего цвета:
Прильём к раствору глюкозы несколько капель раствора сульфата меди (II) и раствор щелочи. Осадка гидроксида меди не образуется. Раствор окрашивается в ярко-синий цвет.
В данном случае глюкоза растворяет гидроксид меди (II) и ведет себя как многоатомный спирт, образуя комплексное соединение.
Видеоопыт «Качественная реакция глюкозы с гидроксидом меди (II)»
2. Взаимодействие с галогеналканами с образованием простых эфиров
Являясь многоатомным спиртом, глюкоза образует простые эфиры:
Реакция происходит в присутствии Ag2O для связывания выделяющегося при реакции НI.
3. Взаимодействие с карбоновыми кислотами или их ангидридами с образованием сложных эфиров.
Например, с ангидридом уксусной кислоты:
Реакции с участием полуацетального гидроксила
1. Взаимодействие со спиртами с образованием гликозидов
Гликозиды – это производные углеводов, у которых гликозидный гидроксил замещен на остаток какого-либо органического соединения.
Содержащийся в циклических формах глюкозы полуацетальный (гликозидный) гидроксил является очень реакционноспособным и легко замещается на остатки различных органических соединений.
В случае глюкозы гликозиды называются глюкозидами. Связь между углеводным остатком и остатком другого компонента называется гликозидной.
Гликозиды построены по типу простых эфиров.
При действии метилового спирта в присутствии газообразного хлористого водорода атом водорода гликозидного гидроксила замещается на метильную группу:
В данных условиях в реакцию вступает только гликозидный гидроксил, спиртовые гидроксильные группы в реакции не участвуют.
Гликозиды играют чрезвычайно важную роль в растительном и животном мире. Существует огромное число природных гликозидов, в молекулах которых с атомом С (1) глюкозы остатки самых различных соединений.
Реакции окисления
Более сильный окислитель – азотная кислота НNO3 – окисляет глюкозу до двухосновной глюкаровой (сахарной) кислоты:
В ходе этой реакции и альдегидная группа – СНО и первичная спиртовая группа — СН2ОН окисляются до карбоксильных – СООН.
Видеоопыт «Окисление глюкозы кислородом воздуха в присутствии метеленового голубого»
С чем взаимодействует глюкоза
Глюкоза С6Н12O6 представляет собой наиболее распространенный и наиболее важный моносахарид — гексозу. Она является структурной единицей большинства пищевых ди- и полисахаридов.
Биологическая роль глюкозы
Глюкоза образуется в природе в процессе фотосинтеза, протекающего под действием солнечного света в листьях растений:
Глюкоза – ценное питательное вещество. Она является обязательным компонентом крови и тканей животных и непосредственным источником энергии для клеточных реакций. При окислении ее в тканях освобождается энергия, необходимая для нормальной жизнедеятельности организмов:
Глюкоза – необходимый компонент обмена углеводов. Она необходима для образования в печени гликогена (запасной углевод человека и животных).
Уровень содержания глюкозы в крови человека постоянен. Во всем объеме крови взрослого человека содержится 5-6 г глюкозы. Такого количества достаточно для покрытия энергетических затрат организма в течение 15 минут его жизнедеятельности.
При снижении ее уровня в крови или высокой концентрации и невозможности использования, как это происходит при сахарном диабете, наступает сонливость, может наступить потеря сознания (гипогликемическая кома).
Строение глюкозы. Изомерия
В молекуле глюкозы присутствуют альдегидная и гидроксильная группы.
Видеоопыт «Распознавание глюкозы с помощью качественных реакций»
Моносахаридам свойственна также иная структура, возникающая в результате внутримолекулярной реакции между карбонильной группой с одним из спиртовых гидроксидов. Такая реакция внутри одной молекулы сопровождается ее циклизацией.
Известно, что наиболее устойчивыми являются 5-ти и 6-ти членные циклы. Поэтому, как правило, происходит взаимодействие карбонильной группы с гидроксилом при 4-м или 5-м углеродном атоме.
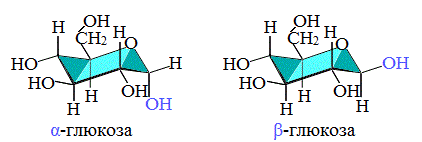
В результате взаимодействия карбонильной группы с одной из гидроксильных глюкоза может существовать в двух формах: открытой цепной и циклической.
Образование циклической формы глюкозы при взаимодействии альдегидной группы и спиртового гидроксила при С5 приводит к появлению нового гидроксила у С1 называемого полуацетальным (крайний правый). Он отличается от других большей реакционной способностью, а циклическую форму в этом случае называют также полуацетальной.
В кристаллическом состоянии глюкоза находится в циклической форме, а при растворении частично переходит в открытую и устанавливается состояние подвижного равновесия.
Например, в водном растворе глюкозы существуют следующие структуры:
Подвижное равновесие между взаимопревращающимися структурными изомерами (таутомерами) называется таутомерией. Данный случай относится к цикло-цепной таутомерии моносахаридов.
Циклические α- и β-формы глюкозы представляют собой пространственные изомеры, отличающиеся положением полуацетального гидроксила относительно плоскости кольца.
С учетом пространственного строения шестичленного цикла
формулы этих изомеров имеют вид:
Видеофильм «Глюкоза и ее изомеры»
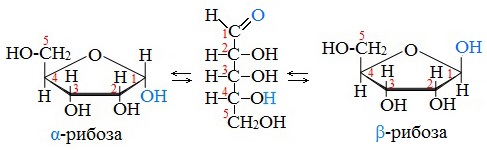
Аналогичные процессы происходят и в растворе рибозы:
В твердом состоянии глюкоза имеет циклическое строение.
Обычная кристаллическая глюкоза – это α-форма. В растворе более устойчива β-форма (при установившемся равновесии на неё приходится более 60% молекул).
Доля альдегидной формы в равновесии незначительна. Это объясняет отсутствие взаимодействия с фуксинсернистой кислотой (качественная реакция альдегидов).
Явление существования веществ в нескольких взаимопревращающихся изомерных формах было названо А. М. Бутлеровым динамической изомерией. Позднее это явление было названо таутомерией.
Для глюкозы кроме явления таутомерии характерны структурная изомерия с кетонами (глюкоза и фруктоза – структурные межклассовые изомеры) и оптическая изомерия:
Физические свойства глюкозы
Глюкоза – бесцветное кристаллическое вещество, хорошо растворимое в воде, сладкое на вкус (лат. «глюкос» – сладкий).
Она содержится в растительных и живых организмах, особенно много ее содержится в виноградном соке (отсюда и название – виноградный сахар), в спелых фруктах и ягодах. Мед в основном состоит из смеси глюкозы с фруктозой.
В крови человека ее содержится примерно 0,1 %
Видеоопыт «Определение глюкозы в виноградном соке»
Получение глюкозы
Основным способом получения моносахаридов, имеющим практическое значения, является гидролиз ди- и полисахароидов.
1. Гидролиз полисахаридов
Глюкозу чаще всего получают гидролизом крахмала (промышленный способ получения):
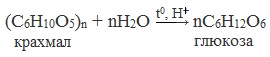
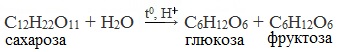
Первый синтез углеводов из формальдегида в щелочной среде осуществил А.М. Бутлеров в 1861 году.
4. Фотосинтез
В природе глюкоза образуется в растениях в результате фотосинтеза:
Применение глюкозы
Глюкоза применяется в медицине в качестве укрепляющего лечебного средства при явлениях сердечной слабости, шоке, для приготовления лечебных препаратов, консервирования крови, внутривенного вливания, при самых разнообразных заболеваниях (особенно при истощении организма).
Широко применяют глюкозу в кондитерском деле (изготовление мармелада, карамели, пряников и т. д.)
Глюкоза находит широкое применение в текстильной промышленности при крашении и печатании рисунков.
Глюкоза применяется в качестве исходного продукта при производстве аскорбиновых и глюконовых кислот, для синтеза ряда производных сахаров и т.д.
Она применяется в производстве зеркал и елочных игрушек (серебрение).
В микробиологической промышленности как питательная среда для получения кормовых дрожжей.
Большое значение имеют процессы брожения глюкозы. Так, например, при квашении капусты, огурцов, молока происходит молочнокислое брожение глюкозы, так же как и при силосовании кормов. Если подвергаемая силосованию масса недостаточно уплотнена, то под влиянием проникшего воздуха происходит маслянокислое брожение и корм становится непригоден к применению.
На практике используется также спиртовое брожение глюкозы, например при производстве пива.
Фруктоза
Фруктоза (фруктовый сахар) С6Н12О6 – изомер глюкозы. Фруктоза в свободном виде содержится в фруктах, меде. Входит в состав сахарозы и полисахарида инсулина. Она слаще глюкозы и сахарозы. Ценный питательный продукт.
В отличие от глюкозы она может без участия инсулина проникать из крови в клетки тканей. По этой причине фруктоза рекомендуется в качестве наиболее безопасного источника углеводов для больных диабетом.
Как и глюкоза, она может существовать в линейной и циклических формах. В линейной форме фруктоза представляет собой кетоноспирт с пятью гидроксильными группами.
Строение ее молекулы можно выразить формулой:
Имея гидроксильные группы, фруктоза, как и глюкоза, способна образовывать сахараты и сложные эфиры. Однако вследствие отсутствия альдегидной группы она в меньшей степени подвержена окислению, чем глюкоза. Фруктоза, также как и глюкоза, не подвергается гидролизу.
Фруктоза вступает во все реакции многоатомных спиртов, но, в отличие от глюкозы, не реагирует с аммиачным раствором оксида серебра.
Углеводы
Теория по теме Углеводы. Краткие конспект по углеводам. Классификация углеводов, химические свойства углеводов, способы получения углеводов. Свойства и получение моносахаридов (глюкоза, фруктоза), олигосахаридов (сахароза и др.), полисахаридов.
| Углеводы (сахара) – органические соединения, имеющие сходное строение, состав большинства которых отражает формула Cx(H2O)y, где x, y ≥ 3. |
Исключение составляет дезоксирибоза, которая имеют формулу С5Н10O4 (на один атом кислорода меньше, чем рибоза).
Классификация углеводов
По числу структурных звеньев
Некоторые важнейшие углеводы: