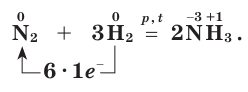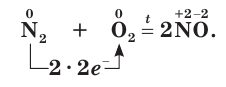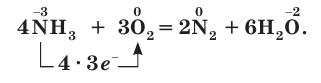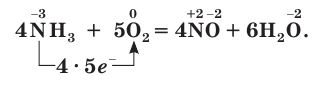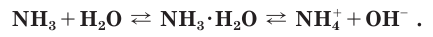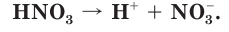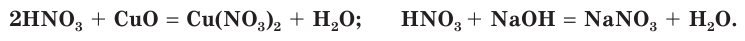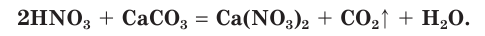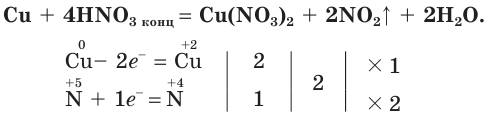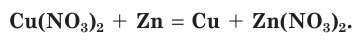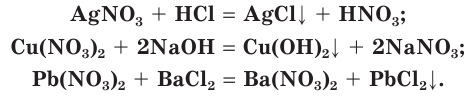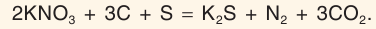С чем взаимодействует азот
Азот и его соединения
Азот обладает высокой электроотрицательностью (3,07), третий после F и O. Проявляет типичные неметаллические (кислотные) свойства, образуя при этом различные кислородсодержащие кислоты, соли и бинарные соединения, а так же катион аммония NH4 и его соли.
В природе – семнадцатый по химической распространенности элемент (девятый среди неметаллов). Жизненно важный элемент для всех организмов.
Азот N2
Простое вещество. Состоит из неполярных молекул с очень устойчивой ˚σππ-связью N≡N, этим объясняется химическая инертность элемента при обычных условиях.
Бесцветный газ без вкуса и запаха, конденсируется в бесцветную жидкость (в отличие от O2).
Главная составная часть воздуха 78,09% по объему, 75,52 по массе. Из жидкого воздуха азот выкипает раньше, чем кислород. Малорастворим в воде (15,4 мл/1 л H2O при 20 ˚C), растворимость азота меньше, чем у кислорода.
При комнатной температуре N2, реагирует с фтором и в очень малой степени – с кислородом:
Обратимая реакция получения аммиака протекает при температуре 200˚C, под давлением до 350 атм и обязательно в присутствии катализатора (Fe, F2O3, FeO, в лаборатории при Pt )
В соответствии с принципом Ле-Шателье увеличение выхода аммиака должно происходить при повышении давления и понижении температуры. Однако скорость реакции при низких температурах очень мала, поэтому процесс ведут при 450-500 ˚C, достигая 15%-ного выхода аммиака. Непрориагировавшие N2 и H2 возвращают в реактор и тем самым увеличивают степень протекания реакции.
Азот химически пассивен по отношению к кислотам и щелочам, не поддерживает горения.
Получение в промышленности – фракционная дистилляция жидкого воздуха или удаление из воздуха кислорода химическим путем, например по реакции 2C(кокс) + O2 = 2CO при нагревании. В этих случаях получают азот, содержащий так же примеси благородных газов (главным образом аргон).
В лаборатории небольшие количества химически чистого азота можно получить по реакции конмутации при умеренном нагревании:
Применяется для синтеза аммиака. Азотной кислоты и других азотсодержащих продуктов, как инертная среда проведения химических и металлургических процессов и хранения огнеопасных веществ.
Аммиак NH3
Качественные реакции – образование белого «дыма» при контакте с газообразным HCl, почернение бумажки, смоченной раствором Hg2(NO3)2.
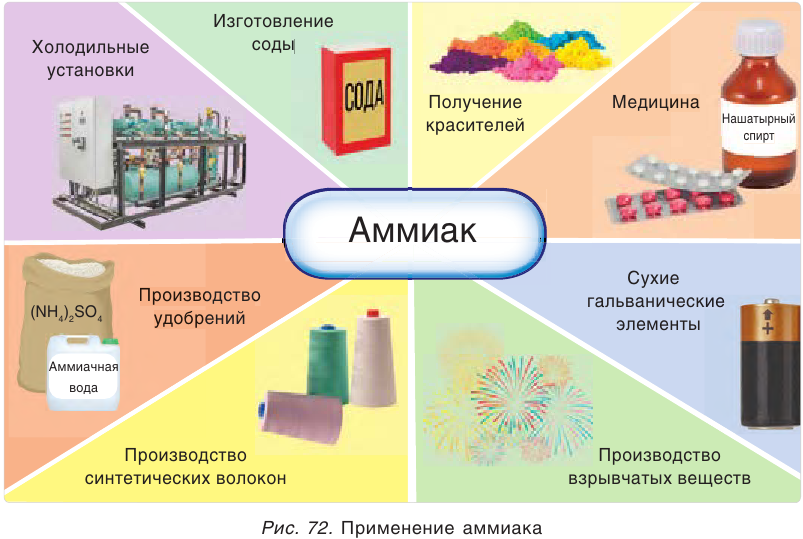
Промежуточный продукт при синтезе HNO3 и солей аммония. Применяется в производстве соды, азотных удобрений, красителей, взрывчатых веществ; жидкий аммиак – хладагент. Ядовит.
Уравнения важнейших реакций:
2NH3(г) ↔ N2 + 3H2
NH3(г) + H2O ↔ NH3 * H2O (р)↔ NH4 + + OH —
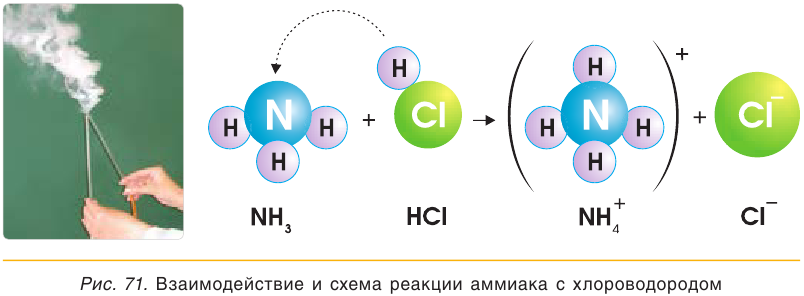
NH3(г) + HCl(г) ↔ NH4Cl(г) белый «дым»
4NH3 + 3O2 (воздух) = 2N2 + 6 H2O (сгорание)
4NH3 + 5O2 = 4NO+ 6 H2O (800˚C, кат. Pt/Rh)
2 NH3 + 3CuO = 3Cu + N2 + 3 H2O (500˚C)
2 NH3 + 3Mg = Mg3N2 +3 H2 (600 ˚C )
NH3(г) + CO2(г) + H2O = NH4HCO3 (комнатная температура, давление)
Получение. В лаборатории – вытеснение аммиака из солей аммония при нагревании с натронной известью: Ca(OH)2 + 2NH4Cl = CaCl2+ 2H2O +NH3
Или кипячение водного раствора аммиака с последующим осушением газа.
В промышленности аммиак получают из азота с водородом. Выпускается промышленностью либо в сжиженном виде, либо в виде концентрированного водного раствора под техническим названием аммиачная вода.
Качественная реакция – образование белого «дыма» при контакте с газообразным HCl. Применяется для создания слабощелочной среды в растворе, при осаждении амфотерных гидроксидов.
В 1 М растворе аммиака содержится в основном гидрат NH3 *H2O и лишь 0,4% ионов NH4 OH (за счет диссоциации гидрата); таким образом, ионный «гидроксид аммония NH4 OH» практически не содержится в растворе, нет такого соединения и в твердом гидрате.
Уравнения важнейших реакций:
NH3 H2O (конц.) = NH3↑ + H2O (кипячение с NaOH)
NH3 H2O + HCl (разб.) = NH4Cl + H2O
3(NH3 H2O) (конц.) + CrCl3 = Cr(OH)3↓ + 3 NH4Cl
8(NH3 H2O) (конц.) + 3Br2(p) = N2↑ + 6 NH4Br + 8H2O (40-50˚C)
2(NH3 H2O) (конц.) + 2KMnO4 = N2↑ + 2MnO2↓ + 4H2O + 2KOH
4(NH3 H2O) (конц.) + Ag2O = 2[Ag(NH3)2]OH + 3H2O
4(NH3 H2O) (конц.) + Cu(OH)2 + [Cu(NH3)4](OH)2 + 4H2O
6(NH3 H2O) (конц.) + NiCl2 = [Ni(NH3)6]Cl2 + 6H2O
Разбавленный раствор аммиака (3-10%-ный) часто называют нашатырным спиртом (название придумано алхимиками), а концентрированный раствор (18,5 – 25%-ный) – аммиачный раствор (выпускается промышленностью).
Оксиды азота
Монооксид азота NO
Диоксид азота NO2
Кислотный оксид, условно отвечает двум кислотам — HNO2 и HNO3 (кислота для N 4 не существует). Бурый газ, при комнатной температуре мономер NO2, на холоду жидкий бесцветный димер N2О4 (тетраоксид диазота). Полностью реагирует с водой, щелочами. Очень сильный окислитель, вызывает коррозию металлов. Применяется для синтеза азотной кислоты и безводных нитратов, как окислитель ракетного топлива, очиститель нефти от серы и катализатор окисления органических соединений. Ядовит.
Уравнение важнейших реакций:
2NO2 ↔ 2NO + O2
4NO2(ж) + H2O = 2HNO3 + N2О3 (син.) (на холоду)
3 NO2 + H2O = 3HNO3 + NO↑
2NO2 + 2NaOH(разб.) = NaNO2 + NaNO3 + H2O
4NO2 + O2+ 2 H2O = 4 HNO3
4NO2 + O2 + KOH = KNO3 + 2 H2O
2NO2 + 7H2 = 2NH3 + 4 H2O (кат. Pt, Ni)
NO2 + 2HI(p) = NO↑ + I2↓ + H2O
NO2 + H2O + SO2 = H2SO4 + NO↑ (50- 60˚C)
NO2 + K = KNO2
6NO2 + Bi(NO3)3 + 3NO (70- 110˚C)
Получение: в промышленности — окислением NO кислородом воздуха, в лаборатории – взаимодействие концентрированной азотной кислоты с восстановителями:
6HNO3 (конц.,гор.) + S = H2SO4 + 6NO2↑ + 2H2O
5HNO3 (конц.,гор.) + P (красный) = H3PO4 + 5NO2 ↑ + H2O
2HNO3 (конц.,гор.) + SO2 = H2SO4 + 2 NO2 ↑
Оксид диазота N2O
Бесцветный газ с приятным запахом («веселящий газ»), N꞊N꞊О, формальная степень окисления азота +1, плохо растворим в воде. Поддерживает горение графита и магния:
2N2O + C = CO2 + 2N2 (450˚C)
N2O + Mg = N2 + MgO (500˚C)
Получают термическим разложением нитрата аммония:
NH4NO3 = N2O + 2 H2O (195- 245˚C)
применяется в медицине, как анастезирующее средство.
Триоксид диазота N2O3
Пентаоксид диазота N2O5
Азотная кислота
Нитриты и нитраты
Нитрит калия KNO2. Белый, гигроскопичный. Плавится без разложения. Устойчив в сухом воздухе. Очень хорошо растворим в воде (образуя бесцветный раствор), гидролизуется по аниону. Типичный окислитель и восстановитель в кислотной среде, очень медленно реагирует в щелочной среде. Вступает в реакции ионного обмена. Качественные реакции на ион NO2 — обесцвечивание фиолетового раствора MnO4 и появление черного осадка при добавлении ионов I. Применяется в производстве красителей, как аналитический реагент на аминокислоты и йодиды, компонент фотографических реактивов.
уравнение важнейших реакций:
2KNO2(т) + 2HNO3(конц.) = NO2↑ + NO↑ + H2O + 2KNO3
2KNO2 (разб.)+ O2(изб.) → 2KNO3 (60-80 ˚C)
KNO2 + H2O + Br2 = KNO3 + 2HBr
5NO2 — + 6H + + 2MnO4 — (фиол.) = 5NO3 — + 2Mn 2+ (бц.) + 3H2O
3 NO2 — + 8H + + CrO7 2- = 3NO3 — + 2Cr 3+ + 4H2O
NO2 — (насыщ.) + NH4 + (насыщ.)= N2↑ + 2H2O
2NO2 — + 4H + + 2I — (бц.) = 2NO↑ + I2(черн.) ↓ = 2H2O
NO2 — (разб.) + Ag + = AgNO2 (светл.желт.)↓
Получение в промышленности – восстановлением калийной селитры в процессах:
KNO3 + Pb = KNO2 + PbO (350-400˚C)
KNO3 (конц.) + Pb(губка) + H2O = KNO2+ Pb(OH)2↓
3 KNO3 + CaO + SO2 = 2 KNO2 + CaSO4 (300 ˚C)
KNO3 + 8H 0 (Al, конц. KOH) = NH3↑ + 2H2O + KOH (80 ˚C)
KNO3 + Pb = KNO2 + PbO (350 — 400 ˚C)

Азот — характеристика элемента, физические и химические свойства простого вещества. Аммиак, соли аммония.
Азотная кислота — строение и химические свойства
С чем взаимодействует азот
Ключевые слова конспекта: свойства простых веществ, азот, строение и физические свойства, химические свойства, производство и применение азота.
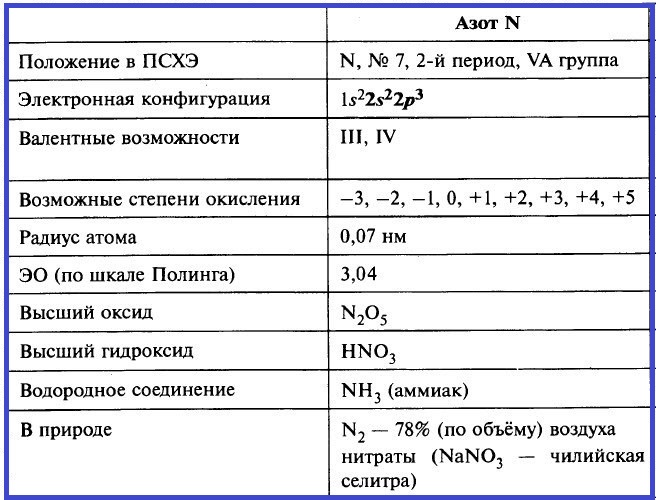
Азот – элемент группы VA. Его важнейшие параметры приведены в таблице.
Таблица «Важнейшие параметры элемента азот»
На валентном энергетическом уровне атома азота нет вакантных орбиталей. Следовательно, электронная пара 2s-подуровня не может быть распарена, и поэтому азот в своих соединениях не может быть пятивалентным. Максимальная валентность азота в соединениях – IV.
Азот проявляет степени окисления от –3 (низшей) до +5 (высшей). Примеры соединений с различными степенями окисления азота приведены в таблице.
Примеры веществ с различными степенями окисления азота и фосфора
СТРОЕНИЕ И ФИЗИЧЕСКИЕ СВОЙСТВА АЗОТА
Для азота не характерна аллотропия, элемент азот образует одно простое вещество – N2. Это молекулярное вещество, молекула азота образована двумя атомами азота, связь – ковалентная неполярная, тройная (одна σ- и две π-связи):
Тройная связь в молекуле азота чрезвычайно прочна, её энергия составляет 946 кДж/моль. Именно это обусловливает крайне низкую реакционную способность азота.
Молекулярный азот – газ (при обычных условиях), без цвета, без запаха, чуть легче воздуха (DB = 28/29 ≈ 0,966), плохо растворим в воде.
ХИМИЧЕСКИЕ СВОЙСТВА АЗОТА
Электроотрицательность элемента азота довольно высока, но химическая активность азота – простого вещества крайне низкая. Это обусловлено прочностью тройной связи в молекуле азота.
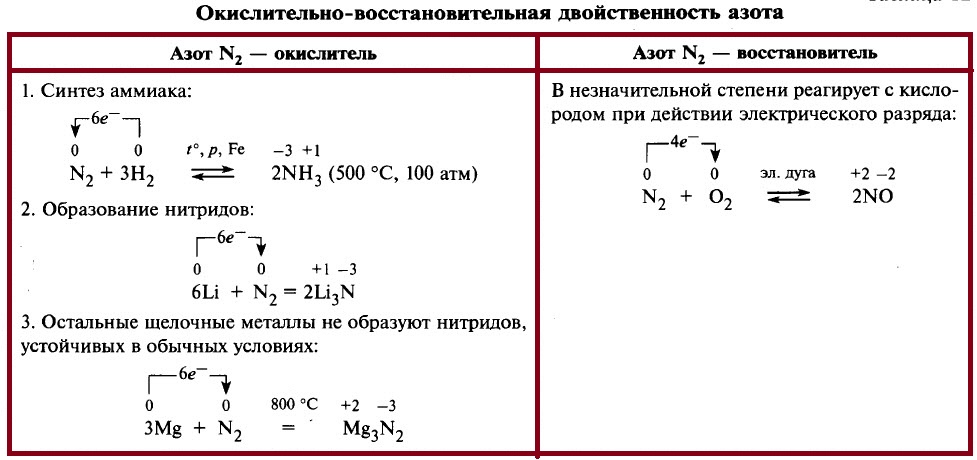
Химические свойства азота представлены в таблице ниже. В обычных условиях азот взаимодействует только с литием Li, при нагревании азoт реагирует с металлами с образованием нитридов. Если говорить о неметаллах, то азот реагирует с водородом и кислородом. С водородом реакция идёт при нагревании и повышенном давлении, требуется катализатор.
Реакция азота с кислородом начинается при температуре 3000–4000 °С, но даже при температуре 4000 °С содержание NO составляет всего около 10%. В отличие от других реакций кислорода с простыми веществами, эта реакция – эндотермическая, на образование 1 моль NO требуется 90 кДж. Обычно реакцию с кислородом осуществляют в электрической дуге, но всё равно она идёт с незначительным выходом продукта.
ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ АЗОТА
В промышленности азот получают методом разделения жидкого воздуха на компоненты. Лабораторным способом получения азота является термическое разложение нитрита аммония:
Эта реакция относится к типу конпропорционирования: восстановителем является азот в составе иона аммония (N –3 ), а окислителем – азот в составе нитрит-иона (N +3 ).
Применение азота. Большая часть азота (примерно 3/4) расходуется для синтеза аммиака, который, в свою очередь, используется для получения удобрений.
Применение газообразного азота обусловлены его инертными свойствами. Газообразный азoт пожаро- и взрывобезопасен, препятствует окислению, гниению.
В лабораториях азот применяется для создания инертной среды при проведении некоторых реакций.
В нефтехимии его применяют для продувки резервуаров и трубопроводов, проверки работы трубопроводов под давлением, увеличения выработки месторождений.
В горнодобывающем деле азот может использоваться для создания в шахтах взрыво–безопасной среды, для распирания пластов породы.
В производстве электроники его применяют для продувки областей, не допускающих наличия окисляющего кислорода.
Aзот используется в коксовом производстве («сухое тушение кокса») при выгрузке кокса из коксовых батарей, а также для «передавливания» топлива в ракетах из баков в насосы или двигатели.
В пищевой промышленности азот используется как газ, наполняющий упаковки, как хладагент.
Газообразным азотом заполняют камеры шин летательных аппаратов.
В жидком азоте, имеющем температуру – 196 °С, хранят в медицинских и исследовательских целях клетки, органы, ткани, другие биологические объекты. Жидкий азот применяют в косметологии для удаления бородавок и родинок.
Конспект урока «Свойства простых веществ: Азот».
Содержание:
Азот — химический элемент и простое вещество:
Неметалл азот N в периодической системе химических элементов открывает VA-группу, в которой также расположены неметаллы фосфор Р и мышьяк As и металлы сурьма Sb и висмут Bi.
Свойства атомов элементов VA-группы, а также свойства их простых веществ закономерно изменяются с ростом их атомного номера: неметаллические свойства ослабевают, а металлические — усиливаются.
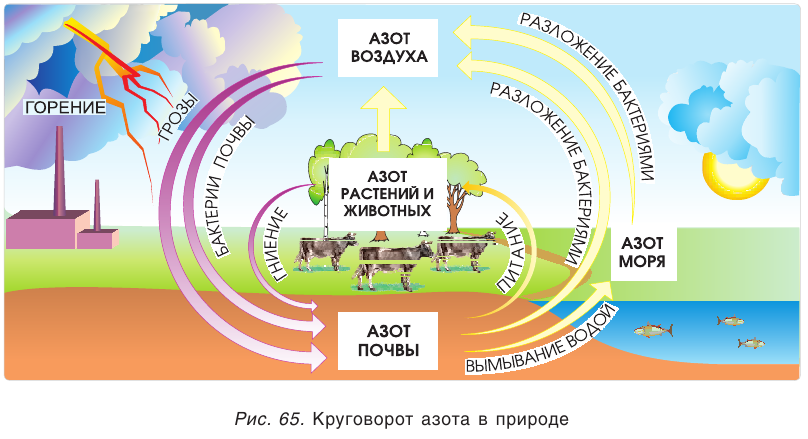
Азот в природе
В природе химический элемент азот находится в виде простого вещества
Строение атомов
В атоме азота 7 электронов, из них 5 располагаются на внешнем электронном слое: 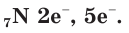
В соединениях с кислородом атом азота проявляет максимальную положительную степень окисления, равную +5, как, например, в азотной кислоте
Строение и физические свойства простого вещества
Простое вещество азот состоит из двухатомных молекул 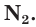
При обычных условиях азот — бесцветный газ, без вкуса и запаха, не поддерживает дыхания и горения, не ядовит. Молекулы азота неполярны, поэтому азот мало растворим в воде. Животные в атмосфере чистого азота погибают из-за того, что лишаются необходимого для дыхания кислорода. С этим связано название азота, происходящее от греческого а — отрицательная приставка, зое — жизнь, т. е. непригодный для жизни.
При повышении давления растворимость азота в тканях организма человека увеличивается. Это приводит к состоянию «азотного наркоза»: водолаз перестает уверенно управлять своими движениями. Поэтому при погружении на большие глубины вместо сжатого воздуха пользуются искусственной дыхательной смесью, в которой азот заменен гелием.
Химические свойства азота
Простое вещество азот 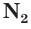
Окислительные свойства азота проявляются в реакциях с водородом и активными металлами. Так, при высокой температуре (t) и большом давлении (p) азот соединяется с водородом в присутствии катализатора, образуя аммиак:
При обычных условиях азот реагирует только с литием, образуя нитрид лития:
С другими металлами азот взаимодействует при высоких температурах.
Восстановительные свойства азота проявляются при его взаимодействии с кислородом. Азот реагирует с кислородом при температуре около 3000 °С, образуя оксид азота(II):
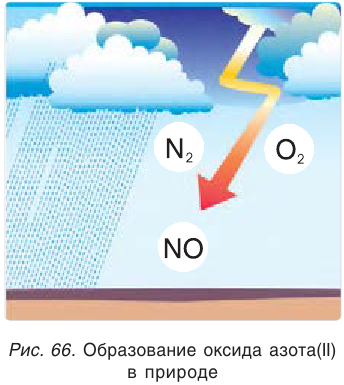
Эта реакция может также протекать при пропускании электрического разряда через смесь газов, например при разряде молнии во время грозы (рис. 66).
Применение азота
Применение азота обусловлено присущими ему свойствами инертного газа. Он используется для продувки и очистки систем трубопроводов и пожаротушения. В атмосфере азота замедляются процессы окисления и гниения, что позволяет увеличить сроки хранения лекарственных препаратов и пищевой продукции — мясных изделий, орехов, чипсов, масла, кофе, пива и др. Поэтому азот используется при их упаковке, а также для создания определенной атмосферы в овощехранилищах.
Жидкий азот, температура которого равна –196 °С, применяется для глубокого охлаждения и вымораживания, в косметологии.
В химической промышленности азот применяется при производстве минеральных удобрений и для синтеза аммиака.
Аммиак
Одним из важнейших соединений азота является аммиак 
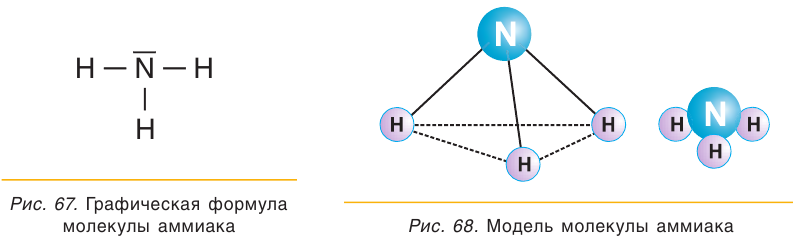
Молекула аммиака имеет форму пирамиды (рис. 68).
Химические связи между атомом азота и атомами водорода в молекуле 

Физические свойства аммиака
Аммиак — бесцветный газ, с резким характерным запахом, ядовит. Он хорошо растворим в воде. В одном объеме воды при комнатной температуре растворяется около 700 объемов аммиака.
Водный раствор с массовой долей аммиака, равной 3 %, в быту называется нашатырным спиртом, под таким же названием он продается в аптеке. В технике водный раствор с массовой долей аммиака, равной 25 %, называют аммиачной водой.
Медики используют водные растворы аммиака (нашатырный спирт) в повседневной практике: ватка, смоченная в нашатырном спирте, выводит человека из обморочного состояния, не причиняя вреда.
При увеличении давления или охлаждении аммиак легко сжижается. Жидкий аммиак при испарении поглощает много теплоты, поэтому его применяют в холодильных установках, а также для получения искусственного льда в спортивных сооружениях.
Химические свойства аммиака
Для аммиака характерны реакции окисления и соединения.
Степень окисления атома азота в аммиаке равна –3, поэтому аммиак проявляет восстановительные свойства, окисляясь кислородом и другими окислителями. Реакция горения аммиака в кислороде описывается уравнением:
В присутствии катализатора (платины) аммиак реагирует с кислородом с образованием оксида азота(II) NO:
Эта реакция лежит в основе промышленного способа получения азотной кислоты. Подробнее этот процесс вы изучите в 11-м классе.
Запомните!
Смеси аммиака с кислородом или воздухом могут взрываться при нагревании, поэтому они опасны
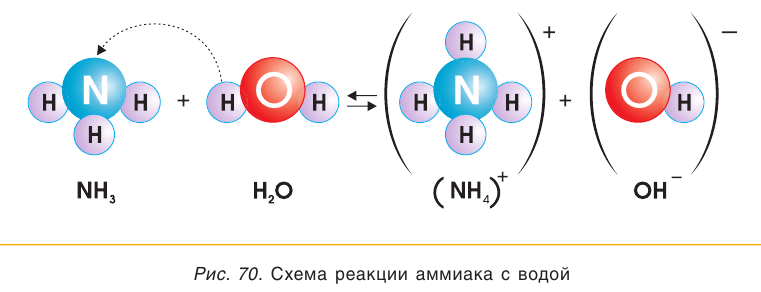
С водой и кислотами аммиак вступает в реакции соединения. Колбу, заполненную аммиаком и закрытую пробкой со вставленной в нее трубочкой, опустим в воду, к которой добавлено несколько капель фенолфталеина (рис. 69). Внутри колбы начнет бить малиновый «фонтан».
При растворении аммиака в воде происходит химическая реакция с образованием гидрата аммиака 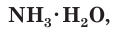


Раствор аммиака в воде (аммиачная вода) за счет присутствия в нем гидроксид-ионов обладает свойствами слабого основания, поэтому в опыте, иллюстрирующем растворимость аммиака в воде, «фонтан» окрашивается в малиновый цвет. Если вместо фенолфталеина в воду добавить лакмус, то раствор окрасится в синий цвет.
Поскольку реакция взаимодействия аммиака с водой обратима, в растворе помимо катионов аммония 

При взаимодействии аммиака с кислотами образуются соли аммония, например хлорид аммония 
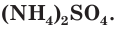
Аммиак способен реагировать и с другими кислотами. Эти реакции протекают без изменения степени окисления атомов азота.
Применение аммиака
По объемам производства в мире аммиак занимает одно из первых мест — ежегодно получают около 100 млн т этого соединения. Аммиак выпускается в жидком виде или в виде водного раствора — аммиачной воды.
Огромные количества аммиака используются для получения азотной кислоты, которая идет на производство удобрений и множества других продуктов.
Из аммиака получают различные соли аммония и мочевину (карбамид).
Аммиак используется также для получения синтетических волокон, лекарственных препаратов, взрывчатых веществ, красителей (рис. 72).
Азотная кислота
Азотная кислота 
Модель молекулы азотной кислоты представлена на рисунке 73.
Физические свойства азотной кислоты
Азотная кислота 
Азотная кислота — сильный электролит, в водном растворе практически полностью диссоциирует на ионы:
Присутствие в разбавленном водном растворе 
Химические свойства азотной кислоты
Подобно другим кислотам, азотная кислота вступает в реакции с осно Ђвными оксидами и основаниями. При этом образуются соли азотной кислоты — нитраты:
Азотная кислота как сильная кислота взаимодействует с солями более слабых кислот. На рисунке 75 показано растворение раковины моллюска, состоящей в основном из карбоната кальция, под действием азотной кислоты с выделением углекислого газа:
Азотная кислота проявляет окислительные свойства по отношению к металлам, но в отличие от других кислот реагирует с большинством металлов, кроме благородных.
При этом водород обычно не выделяется.
Продуктами взаимодействия азотной кислоты с металлами являются нитраты металлов и соединения азота со степенью окисления атомов меньшей, чем в азотной кислоте. Например, если поместить в колбу обрезки медной проволоки и осторожно (в вытяжном шкафу!) прилить к ним концентрированную азотную кислоту, то сразу начнет выделяться «бурый газ» — оксид азота(IV) (рис. 76):
Один объем азотной и три объема соляной кислоты образуют смесь, называемую царской водкой. Она способна растворять даже «царя металлов» — золото.
Азотная кислота способна окислять и другие вещества, как неорганические, так и органические. Поэтому с азотной кислотой надо обращаться крайне осторожно: не проливать, не допускать попадания на кожу (азотная кислота реагирует с белками, вследствие чего на коже образуются желтые пятна), на одежду (разрушаются шерсть и натуральный шелк).
Применение азотной кислоты и нитратов
Азотная кислота — одноосновная кислота, образующая соли нитраты.
Из предыдущего параграфа вы уже знаете, что нитраты образуются при взаимодействии азотной кислоты с различными химическими веществами: металлами, оксидами и гидроксидами металлов, солями слабых кислот.
При обычных условиях нитраты — твердые кристаллические вещества. Все они хорошо растворимы в воде.
Нитраты являются сильными электролитами. При диссоциации этих солей в качестве катионов образуются ионы металлов (или аммония), а в качестве анионов — нитрат-ионы:
В больших количествах нитраты ядовиты.
Нитраты участвуют во всех обменных реакциях, характерных для солей. Они взаимодействуют с металлами, при этом более активный металл вытесняет менее активные из растворов их солей:
Реакции с кислотами, щелочами и солями протекают, если в результате образуются нерастворимые соединения, а нитрат-ионы остаются в растворе, например:
Все нитраты термически неустойчивы. При нагревании они разлагаются с образованием кислорода. Подробнее с этими реакциями вы познакомитесь в курсе химии 11-го класса.
Книга была переведена на многие европейские языки, и чуть ли не два столетия оставалась самой популярной научной работой по артиллерии. В свое время по книге Казимира Семеновича учились Ньютон, российский император Петр I и французский император Наполеон I. Основоположник российской космонавтики К. Э. Циолковский ссылался в некоторых своих работах на труды Казимира Семеновича.
Применение азотной кислоты и нитратов:
Азотная кислота широко используется для получения минеральных удобрений, лекарственных препаратов, взрывчатых веществ и ракетного топлива, полимерных материалов, красителей и т. п.
Очень широка и область применения нитратов. Они используются в качестве удобрений, как окислители — в пиротехнических смесях, для производства стекла.
Нитрат серебра(I) 
Нитраты используются для обработки и консервирования пищевых продуктов. Так нитрат натрия NaNO3 в строго определенном количестве добавляют в мясо при изготовлении колбас. Он восстанавливается микроорганизмами до нитрита натрия NaNO2, который препятствует окислению мяса и способствует сохранению розового цвета мясных изделий. Присутствие нитритов в колбасе необходимо еще и по другой причине: они предотвращают развитие микроорганизмов, выделяющих ядовитые вещества.
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Whatsapp и логотип whatsapp являются товарными знаками корпорации WhatsApp LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.