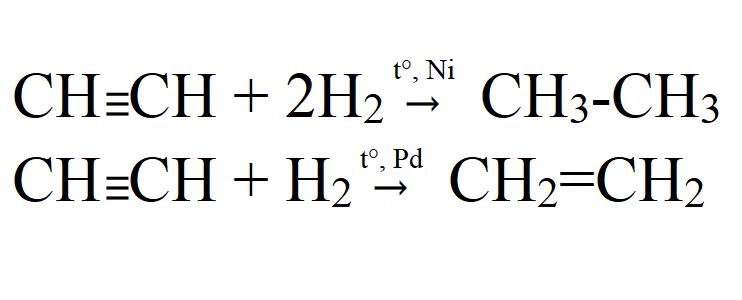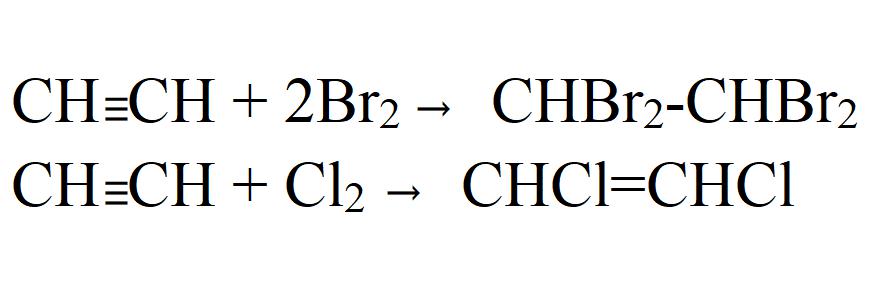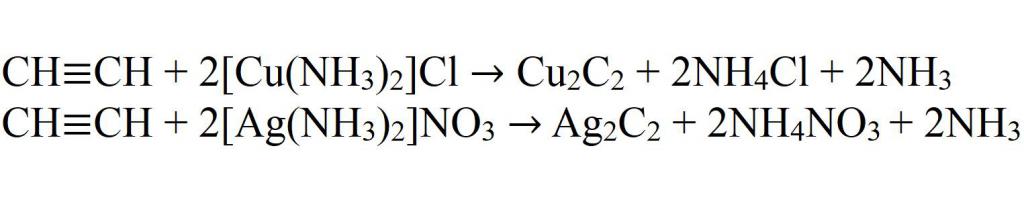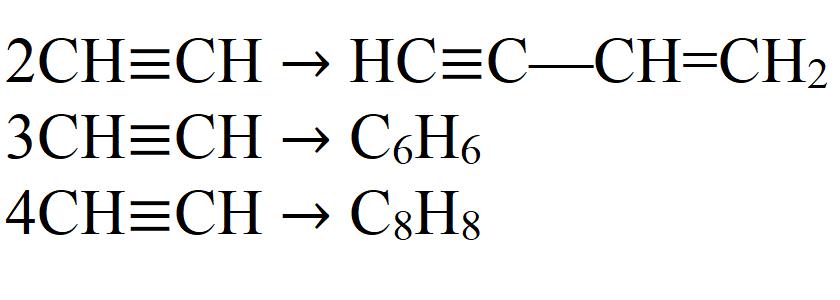С чем взаимодействует ацетилен
Ацетилен
Характеристики и физические свойства ацетилена
Мало растворим в воде и очень хорошо в ацетоне. В виде ацетонового раствора его хранят в стальных баллонах, заполненных каким-нибудь инертным пористым материалом. Смеси ацетилена с воздухом взрывоопасны.
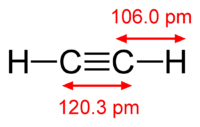
Рис. 1. Строение молекулы ацетилена.
Таблица 1. Физические свойства ацетилена.
Молярная масса, г/моль
Температура плавления, o С
Температура кипения, o С
Получение ацетилена
Выделяют промышленные и лабораторные способы получения ацетилена. Так, в промышленности ацетилен получают путем высокотемпературного крекинга метана:
В лаборатории ацетилен получают гидролизом карбида кальция:
Кроме вышеперечисленных реакций, для получения ацетилена используют реакции дегидрирования алканов и алкенов:
Химические свойства ацетилена
Ацетилен вступает в реакции присоединения, протекающие по нуклеофильному механизму, такие как:
Кроме этого ацетилен способен образовывать соли при взаимодействии с активными металлами (1) и оксидом серебра (2):
2СH≡CH +2Na→2 СH≡C-Na + H2 (1);
Он способен тримеризоваться:
Применение ацетилена
Ацетилен является исходным продуктом для многих важнейших химических производств. Например, из ацетилена получают различные галогенпроизводные, такие как тетрахлорэтан и трихлорэтилен, являющиеся хорошими растворителями, а также винилхлорид, служащий мономером для получения поливинилхлорида. Кроме этого ацетилен используется для получения синтетических каучуков.
Примеры решения задач
| Задание | Эквимолекулярная смесь ацетилена и формальдегида полностью реагирует с 69,6 г Ag2O, растворенного в аммиаке. Определите состав исходной смеси. |
| Решение | Запишем уравнения реакций, указанных в условии задачи: |
Рассчитаем количество вещества оксида серебра (I):
n(Ag2O) = 69,6 / 232 = 0,3 моль.
По уравнению (2) количество вещества формальдегида будет равно 0,1 моль. По условию задачи смесь эквимолекулярна, следовательно, ацетилена тоже будет 0,1 моль.
Найдем массы веществ, составляющих смесь:
m(HC≡CH) = 0,1 × 26 = 2,6 г;
m(H-C(O)H) = 0,1 × 30 = 3 г.
| Задание | При пропускании смеси пропана и ацетилена через склянку с бромной водой масса склянки увеличилась на 1,3 г. При полном сгорании такого же количества исходной смеси углеводородов выделилось 14 л (н.у.) оксида углерода (IV). Определите массовую долю пропана в исходной смеси. |
| Решение | При пропускании смеси пропана и ацетилена через склянку с бромной водой происходит поглощение ацетилена. Запишем уравнение химической реакции, соответствующее этому процессу: |
Таким образом, значение, на которое увеличилась масса склянки (1,3 г) представляет собой массу ацетилена. Найдем количество вещества ацетилена (молярная масса – 26 г/моль):
Запишем уравнение реакции сгоранияацетилена:
Согласно уравнению реакции, в неё вступило 2 моль ацетилена, однако, известно, что 0,05 моль из этого количества поглотилось бромной водой. Т.е. выделилось:
Найдем общее количество оксида углерода (IV):
Запишем уравнение реакции сгорания пропана:
Учитывая, что в реакции сгорания ацетилена выделилось 0,1 моль оксида углерода (IV), количество вещества оксида углерода (IV), выделившееся в ходе сгорания пропана равно:
0,625 — 0,1 = 0,525 моль СО2.
Найдем количество вещества пропана, вступившего в реакцию горения. Согласно уравнению реакции n(CO2) : n(С3Н8) = 3 : 1, т.е.
Вычислим массу пропана (молярная масса 44 г/моль):
Тогда, общая масса смеси углеводородов составит:
Ацетилен
Бесцветный газ, слаборастворимый в воде, несколько легче атмосферного воздуха, относящийся к классу алкинов и представляющий собой ненасыщенный углерод называют ацетиленом. В его структуре все атомы имеют между собой тройную связь. Это вещество закипает при температуре — 830 °С. Формула ацетилена говорит о том, что в его состав входят только углерод и водород.
Ацетилен – это опасное вещество, которое при неаккуратном обращении с ним может взорваться. Именно поэтому для хранения этого вещества используют специально оснащенные емкости. Газ при соединении с кислородом горит, и температура может достигать 3150 °С.
Получение ацетилена
Ацетилен можно получить в лабораторных и промышленных условиях. Для получения ацетилена в лаборатории достаточно на карбид кальция (это его формула — СаС2) капнуть небольшое количество воды. после этого начинается бурная реакция выделения ацетилена. Для ее замедления допустимо использовать поваренную соль (формула NaCl).
В промышленных условиях все несколько сложнее. Для производства ацетилена применяют пиролиз метана, а так же пропана, бутана. В последнем случае формула ацетилена будет содержать большое количество примесей.
Карбидный способ производства ацетилена обеспечивает производство чистого газа. Но, такой метод получения продукта должен быть обеспечен большим количеством электроэнергии.
Пиролиз не требует большого количества электричества, все дело в том, что для производства газа, необходимо выполнить нагрев реактора и для этого используют газ, циркулирующий в первом контуре реактора. Но в потоке, который там перемещается, концентрация газа довольно мала.
Выделение ацетилена с чистой формулой во втором случае не самая простая задача и ее решение обходится довольно дорого. Существует несколько способов производства формулы ацетилена в промышленных условиях.
Электрический крекинг
Технологическая схема крекинга
Пиролиз окислительный
Этот способ основан на перемешивании метана и кислорода. После производства смеси, часть ее отправляют на сжигание и полученное тепло отправляют на нагревание сырья до температуры в 16000 °С. Такой процесс отличается непрерывностью и довольно скромными затратами электрической энергии. На сегодня этот метод чаще всего можно встретить на предприятиях по производству ацетилена.
Технологическая схема процесса окислительного пиролиза
Кроме перечисленных технологий производства формулы ацетилена применяют такие как — гомогенный пиролиз, низкотемпературную плазму. Все они отличаются количеством энергетических затрат и в итоге разными характеристиками получаемого газа и его формулой.
Преимущества
Упоминание о газовой сварке моментально наводит на мысли об ацетилене. Действительно для этого процесса чаще всего применяют этот газ. Он в сочетании с кислородом обеспечивает самую высокую температуру горения пламени. Но в последние годы из-за развития различных видов сварки использование этого вида соединения металлов несколько снизилось. Более того, в некоторых отраслях произошел полный отказ от применения этих технологий. Но для выполнения определенного вида ремонтных работ она до сих пор остается незаменима.
Применение ацетилена позволяет получить следующие преимущества:
Вместе с тем, у ацетилена есть и определенные недостатки, которые ограничивают его использование. Самый главный — это взрывоопасность. При работе с этим газом необходимо строго соблюдать меры безопасности. В частности, работы должны выполняться в хорошо проветриваемом помещении. При нарушении режимов работы возможно появление некоторых дефектов, например, пережогов.
Формула ацетилена
Строение молекулы ацетилена
Ацетилен имеет простую формулу — С2Н2. Относительно дешевый способ его получения путем перемешивания воды и карбида кальция сделал его самым применяемым газом для соединения металлов. Температура с которой горит смесь кислорода и ацетилена вынуждает выделяться твердые частицы углерода.
Ацетилен можно доставить к месту выполнения работ в специальных емкостях (газовых баллонах), а можно получить его непосредственно на рабочем месте используя для этого специально сконструированный реактор. Где происходит смешивание воды и карбида кальция.
Химические и физические свойства
Некоторые химические свойства
Свойства ацетилена во многом определены его формулой. То есть наличием атомов углерода и водорода связанных между собой.
Смешивание ацетилена с водой, при добавлении катализаторов типа солей ртути, приводит к получению уксусного альдегида. Тройная связь атомов, содержащихся в молекуле ацетилена приводит к тому, что при сгорании она выделяет 14 000 ккал/куб. м. В процессе сгорания температура поднимается до 3000 °C.
Этот газ, при соблюдении определенных условий, может превращаться в бензол. Для этого необходимо разогреть его до 4000 °С и добавить графит.
Водород, содержащийся в молекулах показывает кислотные свойства. То есть они довольно легко отрываются от молекулы в виде протонов. Ацетилен в состоянии обесцвечивает воду содержащую бром и раствор «марганцовки».
Молярная масса ацетилена составляет 26,04 г/моль. Плотность ацетилена 1,1 кг/м³.
Физические свойства
Этот газ недопустимо выпускать в атмосферу. Его формула может отрицательно сказываться на окружающей среде.
Технология и режимы сварки
Ацетилено — кислородные смеси применяют для соединения деталей из углеродистых и низколегированных сталей. Например, этот метод широко применяют для создания неразъемных соединений трубопроводов. Например, труб диаметром 159 мм с толщиной стенок не более 8 мм. Но существуют и некоторые ограничения, так соединение таким методом сталей марок 12×2M1, 12×2МФСР недопустимо.
Выбор параметров режима
Для приготовления смеси необходимой для соединения металлов используют формулу 1/1,2. При обработке заготовок из легированных сталей сварщик должен отслеживать состояние пламени. В частности, нельзя допускать переизбытка ацетилена.
Расход смеси с формулой кислород/ацетилен составляет 100-130 дм 3 /час на 1 мм толщины. Мощность пламени регулируют с помощью горелки, которые подбирают в зависимости от используемого материала, его характеристик, толщины и пр
Для выполнения сварки при помощи ацетилена применяют сварочную проволоку. Ее марка должна соответствовать марке сталей свариваемых деталей. Диаметр проволоки определяют в зависимости от толщины свариваемого металла.
Для удобства технологов и непосредственно сварщиков существует множество таблиц, на основании которых можно довольно легко выбрать сварочный режим. Для этого необходимо знать следующие параметры:
Сварку выполняют небольшими участками по 10-15 мм. Работа производится в следующей последовательности. На первом этапе выполняют оплавление кромок. После этого выполняют наложение корня шва. По окончании формирования корня, можно продолжать сварку далее. Если толщина заготовок составляет 4 мм то сварку допустимо выполнять в один слой. Если толщина превышает указанную, то необходимо наложить второй. Его укладывают только после того, как выполнен корень шва по всей заданной длине.
Для улучшения качества сварки допускается выполнение предварительного нагрева. То есть будущий сварной стык прогревают с помощью горелки. Если принят за основу такой способ, то прогрев надо выполнять после каждой остановки заново.
Выполнение швов газом может выполняться в любом пространственном положении. Например, при выполнении вертикального шва существуют свои особенности. Так, вертикальный шов должен исполняться снизу вверх.
При выполнении сварочных работ перерывы в работе недопустимы, по крайней мере до окончания всей разделки шва. При остановке в работе горелку необходимо отводить медленно, в противном случае, могут возникнуть дефекты шва — раковины и поры. Интересная особенность существует при сварке трубопроводов, в ней не допустим сквозняк и поэтому концы труб необходимо заглушать.
Виды ацетилена
Промышленность выпускает два вида ацетилена — твердый и в виде газа.
Газообразный
Ацетилен обладает резким запахом и это дает определённые преимущества при его утечке. По своей массе он близок к атмосферному воздуху.
Жидкий
Реакции ацетилена
Ацетилен вступает в реакцию с различными соединениями, например, солями меди и серебра. В результате таких взаимодействий получают вещества под названием ацетилениды. Их отличительная черта — взрывоопасность.
Использование ацетилена
Кроме сварки ацетилен применяют в следующих случаях:
Стандарты
Производители ацетилена руководствуются при его получении требованиями ГОСТ 5457-75. В нем определены требования к газообразному и жидкому ацетилену.
Газ в баллоне
Для хранения и транспортировки ацетилена применяют газовые баллоны. Для изготовления этого устройства применяют бесшовную трубу, которую производят на основании ГОСТ 949-73. В нижней части корпуса устанавливают специальную опору, которая позволяет его устанавливать в вертикальное положение. В верхней части баллона устанавливают вентиль, через который выполняют заправку/отдачу газа. Эти вентили выпускают под маркой ВБА-1 или BA-I. Их применение допустимо только на баллонах предназначенном для хранения этого газа.
Ацетилен в баллонах
На поверхности баллона должны быть выбиты следующие данные:
Товарный знак производителя, дата производства, параметры давления и некоторые другие, которые характеризуют это изделие.
На поверхность баллонов наносят краску белого цвета. Кроме этого, в обязательном порядке должны быть нанесена надпись АЦЕТИЛЕН. При этом высота шрифта не должна быть менее 6 см.
Баллон заполняют пористым наполнителем. Его задача более равномерное распределение газа внутри баллон, другая задача заключается в предохранении газа от распада.
Ацетилен: химические свойства, получение, применение, меры предосторожности
Получение
Карбидный метод основан на реакции взаимодействия карбида кальция с водой. Карбид кальция получают из его оксида, сплавляя с коксом в электропечах. Отсюда и такой высокий расход энергии. Зато чистота ацетилена, получаемого таким способом, крайне высока (99,9 %).
В лаборатории ацетилен также можно получить дегидрогалогенированием дигалогенпроизводных алканов с помощью спиртового раствора щелочи.
Физические свойства ацетилена
Химические свойства ацетилена
Исходя из тройной связи ацетилена, для него будут характерны реакции присоединения и реакции полимеризации. Атомы водорода в молекуле ацетилена могут замещаться другими атомами или группами. Поэтому можно сказать, что ацетилен проявляет кислотные свойства. Разберем химические свойства ацетилена на конкретных реакциях.
2CH≡CH + 2Na → 2CH≡CNa + H2
Это далеко не все химические свойства ацетилена.
Применение
Пламя горения ацетилена имеет также очень высокую яркость, поэтому его часто используют в осветительных приборах. Используется он и во взрывотехнике. Правда, там применяется не сам ацетилен, а его соли.
Как видно из разнообразных химический свойств, ацетилен может применяться как сырье для синтеза других важных веществ: растворителей, лаков, полимеров, синтетических волокон, пластмасс, органического стекла, взрывчатых веществ и уксусной кислоты.
Безопасность
Этот газ обладает и токсичным действием. При его вдыхании начнется интоксикация организма. Признаками отравления являются тошнота, рвота, шум в ушах, головокружение. Большие концентрации могут приводить даже к потере сознания.
Ацетилен, получение, свойства, химические реакции
Ацетилен, получение, свойства, химические реакции.
Ацетилен, C2H2 – органическое вещество класса алкинов, непредельный углеводород.
Ацетилен, формула, газ, характеристики:
Химическая формула ацетилена C2H2. Структурная формула ацетилена СH≡CH. Изомеров не имеет.
Строение молекулы ацетилена:
Ацетилен обладает незначительным токсическим действием.
Физические свойства ацетилена:
| Наименование параметра: | Значение: |
| Цвет | без цвета |
| Запах | без запаха |
| Вкус | без вкуса |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | газ |
| Плотность (при 20 °C и атмосферном давлении 1 атм.), кг/м 3 | 1,0896 |
| Плотность (при 0 °C и атмосферном давлении 1 атм.), кг/м 3 | 1,173 |
| Температура плавления, °C | -80,8 |
| Температура кипения, °C | -80,55 |
| Тройная точка, °C | 335 |
| Температура самовоспламенения, °C | 335 |
| Давление самовоспламенения, МПа | 0,14-0,16 |
| Критическая температура*, °C | 35,94 |
| Критическое давление, МПа | 6,26 |
| Взрывоопасные концентрации смеси газа с воздухом, % объёмных | от 2,1 до 100 |
| Удельная теплота сгорания, МДж/кг | 56,9 |
| Температура пламени, °C | 3150-3200 |
| Молярная масса, г/моль | 26,038 |
* при температуре выше критической температуры газ невозможно сконденсировать ни при каком давлении.
Химические свойства ацетилена:
Химические свойства ацетилена аналогичны свойствам других представителей ряда алкинов. Поэтому для него характерны следующие химические реакции:
СH≡CH + Br2 → CHBr=CHBr (1,2-дибромэтен);
3СH≡CH → C6H6 (бензол) (kat = активированный уголь, t o = 450-500 о С).
Реакция тримеризации ацетилена является частным случаем реакции полимеризации ацетилена и происходит при пропускании ацетилена над активированным углем при температуре 450-500 о С.
СH≡CH + СH≡CH → CH2=CH-С≡CH (винилацетилен) (kat = водный раствор CuCl и NH4Cl).
Реакция димеризации ацетилена является частным случаем реакции полимеризации ацетилена.
Ацетилен горит белым ярким пламенем.
Протекание реакции и её продукты определяются средой, в которой она протекает.
СH≡CH + Н2 → C2H4 ( этилен ) (kat = Ni, Pd или Pt, повышенная t o );
СH≡CH + 2Н2 → C2H6 ( этан ) (kat = Ni, Pd или Pt, повышенная t o ).
Получение ацетилена в промышленности и лаборатории. Химические реакции – уравнения получения ацетилена:
Ацетилен в лабораторных условиях получается в результате следующих химических реакций:
Ацетилен в промышленности получают следующими способами и методами:
Сначала получают известь из карбоната кальция.
CаСО3 → CаО + CO2. (t o = 900-1200 о С).
CаО + 3С → CаС2 + CO. (t o = 2500-3000 о С).
Далее карбид кальция обрабатывают водой по известной реакции.
В итоге получается ацетилен высокой чистоты – 99,9 %.
Высокотемпературный крекинг метана осуществляется по известной реакции дегидирования метана в электродуговых печах при температуре 2000-3000 °С и напряжении между электродами 1000 В. Выход ацетилена составляет 50 %.
Применение и использование ацетилена:
– для газовой сварки и резки металлов,
Взрывоопасность ацетилена и безопасность при обращении с ним:
Ацетилен обладает взрывоопасными свойствами.
Поэтому обращение с ацетиленом требует строгого соблюдения правил техники безопасности.
Ацетилен горит и взрывается даже в отсутствии кислорода и других окислителей.
Смеси ацетилена с воздухом взрывоопасны в очень широком диапазоне концентраций.
Струя ацетилена, выпущенная на открытый воздух, может загореться от малейшей искры, в том числе от разряда статического электричества с пальца руки.
Взрываемость ацетилена зависит от множества факторов: давления, температуры, чистоты ацетилена, содержания в нем влаги, наличия катализаторов и пр. веществ и ряда других причин.
Температура самовоспламенения ацетилена при нормальном – атмосферном давлении колеблется в пределах 500-600 °C. При повышении давления существенно уменьшается температура самовоспламенения ацетилена. Так, при давлении 2 кгс/см 2 (0,2 МПа, 1,935682 атм.) температура самовоспламенения ацетилена равна 630 °C. А при давлении 22 кгс/см 2 (2,2 МПа, 21,292502 атм.) температура самовоспламенения ацетилена равна 350 °С.
Присутствие в ацетилене частиц различных веществ увеличивают поверхность его контакта и тем самым снижает температуру самовоспламенения при атмосферном давлении. Например, активированный уголь снижает температуру самовоспламенения ацетилена до 400 °С, гидрат оксида железа (ржавчина) – до 280-300 °С, железная стружка – до 520 °С, латунная стружка – до 500-520 °С, карбид кальция – до 500 °С, оксид алюминия – до 490 °С, медная стружка – 460 °С, оксид железа – 280 °С, оксид меди – до 250 °С.
Для хранения и перевозки ацетилена используются специальные стальные баллоны белого цвета (с красной надписью «А»), заполненные инертным пористым материалом (например, древесным углём). При этом ацетилен хранится и перевозится в указанных баллонах в виде раствора ацетилена в ацетоне под давлением 1,5-2,5 МПа.
Примечание: © Фото //www.pexels.com, //pixabay.com
как получить ацетилен реакция ацетилен этен 1 2 вещество кислород водород связь является углекислый газ бромная вода
уравнение реакции масса объем полное сгорание моль молекула смесь превращение горение получение ацетилена
напишите уравнение реакций ацетилен