С чем взаимодействует agno3
Взаимодействие серебра с кислотами
В этой статьи мы рассмотрим вопросы химического взаимодействия серебра с различными кислотами. Содержание статьи является информативным, мы не рекомендуем производить химические реакции в домашних условиях, это может быть опасным.
Как взаимодействуют кислоты с серебром?
Серебро – химически малоактивно, поэтому его относят к семейству благородных металлов. В воздухе серебро (как химическое вещество) практически не окисляется, с водой не взаимодействует, является инертным металлом. Серебро в обычных условиях слабо взаимодействует с различными кислотами. Объясняется это тем фактом, что в электрохимическом ряду оно стоит после водорода. Серебро не вступает в химическую реакцию с соляной и разбавленной серной кислотой.
Серебро окисляется в реакции с горячей концентрированной серной кислотой и соляной кислотой в присутствии свободного кислорода. Серебро может вступать в химическую реакцию с кислотами, которые проявляют свойства окислителей, то есть содержать кислород.
Свойства серебра слабого взаимодействия с кислотами активно используется при производстве:
Серебро устойчиво к действию многих холодных и горячих кислот, щелочах и растворах солей, а также в ряде органических соединений. Холодная соляная кислота медленно действует на серебро благодаря образованию нерастворимой пленки из хлорида серебра.
В этой статье мы рассмотрим следующие химические реакции:
Взаимодействие серебра с соляной кислотой
Серебро не растворяется в соляной кислоте из-за появления тонкого слоя хлорида серебра. При условии добавления к раствору свободного кислорода в виде перекиси водорода реакция приведет к окислению серебра в хлорид серебра.
Взаимодействие серебра с серной кислотой
Серебро реагирует с концентрированными растворами серной кислоты с образованием соли.
Разбавленная серная кислота при комнатной температуре не взаимодействует с серебром, концентрированная кислота — взаимодействует.
Взаимодействие серебра с азотной кислотой
Серебро реагирует с концентрированными растворами азотной кислот с образованием соли.
Химическая реакция — — > Ag +2HNO3 = AgNO3 + NO2 + H2O.
Химическая реакция — — > 3Ag + 4HNO3 = 3AgNO3 + NO + 2H2O.
Азотная кислота растворяет серебро при различных температурах и концентрациях, а царская водка образует на его поверхности нерастворимую пленку из хлорида серебра.
Другие химические реакции серебра и кислот
Уксусная кислота не действует на серебро при низкой и высокой температурах, но при добавлении в нее небольшого количества соляной кислоты начинается растворение серебра.
Серебро не вступает во взаимодействие с фосфорной кислотой любой концентрации.
Авторские ювелирные брелоки по выгодной цене
Нитрат серебра (Азотнокислое серебро)
Нитрат серебра это бесцветные кристаллы которые очень быстро растворяются в воде и некоторых других растворителях, обладает токсичными свойствами.
Попадание на открытую кожу образует при длительном контакте химический ожог, при недолгом некоторое потемнение кожи от синевато фиолетового до черного цвета.
Именно поэтому получил название (адский камень), другое название : азотно-кислое серебро, ляпис (от слова камень).
Почти во всех реакциях проявляет окислительные свойства, признак реакции с нитратом серебра и хлоридом натрия, а также соляной кислотой это белый творожистый осадок хлорида серебра.
Который сереет на свету связи частичного восстановления серебра.
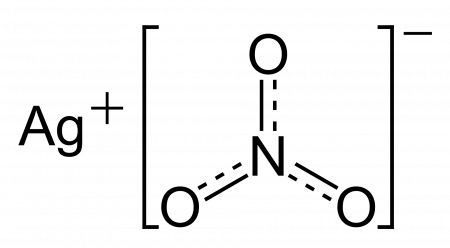
Нитрат серебра AgNO3
Что такое нитрат серебра это неорганическое соединение, соль серебра, очень реакционно способное вещество (образует химические ожоги при попадания на кожу), как и все нитраты проявляет окислительные свойства.
( Ляпис ) основное получение реакцией серебра с азотной кислотой :
Получение нитрата серебра
Основное получение действием азотной кислоты на серебро содержащие материалы или шлам, основывается на окислении серебра сильной азотной кислотой, в результате чего получается нитрат серебра (азотно кислое серебро) оксид азота и вода.
В результате получается технический нитрат, для очищения реагируют с хлоридом натрия, почти чистый хлорид серебра (творожистый осадок) восстанавливают до металлического серебра, получается чистый нитрат серебра.
В производственных масштабах чистый нитрат серебра, получают из уже аффинированного серебра (не менее 99,8 %), реагируя его с азотной кислотой в присутствии кислорода (для доокисления высших в более высокие оксиды азота).
Применение
Для лечения некоторых болезней язв, в акушерстве. Служит источником для получения других веществ в том числе и некоторых органических. В анализе серебра содержащих материалов, в производстве зеркал и зеркальных покрытий.
В недавнем прошлом применялся как компонент проявителя для фотографий, фотоэмульсий, а также для усилителей и других серебро содержащих растворов.
Ионы серебра применяются в косметических средствах, мазях для борьбы с угрями и прыщами.
Свойства нитрата серебра
Теплоёмкость 93,0 Дж/(моль·К). Энтальпия образования −124,5 кДж/моль. Энтропия 140,9 Дж/(моль·К) при 298 К.
Реакции нитрата
Реакция с щелочами приводит к образованию оксида серебра ( I ) и нитрата щёлочи :
Карбонат натрия приводит к образованию карбоната серебра и нитрата серебра :
Реакция с серной кислотой ( конц. ) приводит к образованию сульфата серебра и азотной кислоты :
Взаимодействие сульфата натрия даёт сульфат серебра и нитрат натрия :
Реакция с ортофосфатом натрия даёт ортофосфат серебра и нитрат натрия :
Реакция с соляной кислотой приводит к образованию хлорида серебра :
Реакция с хлором приводит к образованию оксида азота ( V ) кислорода и хлорида серебра реакция протекает в присутствии четырёх хлористого углерода ( катализатор ) при 0°C :
Реакция с сероводородом даёт сульфит серебра и азотную кислоту :
С разбавленной даёт оксид серебра ( I ) и аммиачную селитру :
Подобно себя ведёт тиосульфат натрия в концентрированном состоянии даёт комплексное соединение и нитрат натрия :
В разбавленном состоянии даёт тиосульфат серебра :
Реакция с концентрированными цианидами приводит к комплексному соединению дицианоаргентат( I ) натрия и нитрата натрия :
С разбавленным цианид серебра и нитрат натрия :
С концентрированным роданид (тиоцианат) калия даёт комплексное соединение дицианоаргентумат калия и нитрат калия :
С разбавленным нитрат калия и тиоцианат серебра :
Концентрированный нитрит калия даёт комплексное соединение и нитрат калия :
С разбавленным нитрат калия и нитрит серебра :
Реакция с концентрированным с сульфитом натрия даёт комплексное соединение битиосульфатоаргенат ( I ) натрия и нитрат натрия :
С разбавленным сульфит серебра и нитрат натрия :
Статья на тему нитрат серебра
Похожие страницы:
Понравилась статья поделись ей
Нитрат серебра I
| Нитрат серебра | |
|---|---|
 | |
| Систематическое наименование | Нитрат серебра |
| Традиционные названия | Адский камень, ляпис |
| Хим. формула | AgNO3 |
| Рац. формула | AgNO3 |
| Состояние | твёрдое |
| Молярная масса | 169,87 г/моль |
| Плотность | 4,352 |
| Температура | |
| • плавления | 209,7 |
| • разложения | 440 |
| Мол. теплоёмк. | 93,1 Дж/(моль·К) |
| Энтальпия | |
| • образования | −124,4 кДж/моль |
| Растворимость | |
| • в воде | 122,2 (0 °C); 222,5 (20 °C); 373 (40 °C); 912 (100 °C) |
| Показатель преломления | 1,744 |
| Рег. номер CAS | 7761-88-8 |
| PubChem | 24470 |
| Рег. номер EINECS | 231-853-9 |
| SMILES | |
| RTECS | VW4725000 |
| ChEBI | 32130 |
| Номер ООН | 1493 |
| ChemSpider | 22878 |
| ЛД50 | 20 мг/кг (собака, орально) 800 мг/кг (кролик, орально) |
| Токсичность | ядовит, коррозионно-активен |
| Пиктограммы СГС | 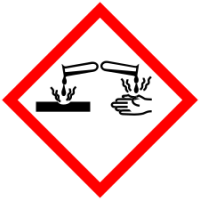    |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Нитрат серебра (азотнокислое серебро, «адский камень», ляпис от итал. lapis «карандаш» /лат. lapis «камень») — неорганическое соединение, соль металла серебра и азотной кислоты с формулой AgNO3, бесцветные ромбические кристаллы, растворимые в воде. Не образует кристаллогидратов.
Содержание
Получение
Нитрат серебра может быть получен растворением серебра в азотной кислоте по реакции:
Ag + 2 HNO3 ⟶ AgNO3 + NO2 ↑ + H2O
Физические свойства
Нитрат серебра(I) обладает жгуче-кислым вкусом.
Химические свойства
Нитрат серебра является реактивом на соляную кислоту и соли соляной кислоты, поскольку взаимодействует с ними с образованием белого творожистого осадка хлорида серебра, нерастворимого в азотной кислоте:
HCl + AgNO3 ⟶ AgCl ↓ + HNO3 NaCl + AgNO3 ⟶ AgCl ↓ + NaNO3
Образует осадки с водными растворами бромидов, йодидов, фосфатов, тиоцианатов, цианидов, сульфидов.
При нагревании разлагается, выделяя металлическое серебро:
Применение
Нитрат серебра применяется:
Использование в медицине
Нитрат серебра используется в медицине в виде сплава нитрата серебра и нитрата калия) иногда отлитый в виде палочек — ляписного карандаша для прижигания и стерилизации ран, удаления мелких бородавок.
Лечебное действие нитрата серебра заключается в подавлении жизнедеятельности микроорганизмов, в небольших концентрациях он действует как прижигающее, противовоспалительное и вяжущее средство, а концентрированные растворы, как и кристаллы AgNO3, прижигают живые ткани.
Впервые ляпис (адский камень) применили врачи Ян-Баптист ван Гельмонт и Франциск де ла Бое Сильвий, которые научились получать нитрат серебра взаимодействием металла с азотной кислотой. Они обнаружили, что прикосновение к кристаллам полученного вещества приводит к появлению на коже чёрных пятен, а при длительном контакте — глубоких ожогов.
Токсичность
Коррозионно-активен, при контакте с кожей может вызывать химические ожоги. Оставляет на коже чёрные пятна.
Нитрат серебра(I)
| Под вечный гул вертящихся колес. Нитрат серебра | |
 | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Нитрат серебра |
| Традиционные названия | Адский камень, ляпис |
| Химическая формула | AgNO3 |
| Эмпирическая формула | AgNO3 |
| Физические свойства | |
| Состояние (ст. усл.) | твёрдое |
| Плотность | 4,352 г/см³ |
| Термические свойства | |
| Температура плавления | 209,7 °C |
| Химические свойства | |
| Растворимость в воде | 122,2 (0 °C); 222,5 (20 °C); 770 (100 °C) г/100 мл |