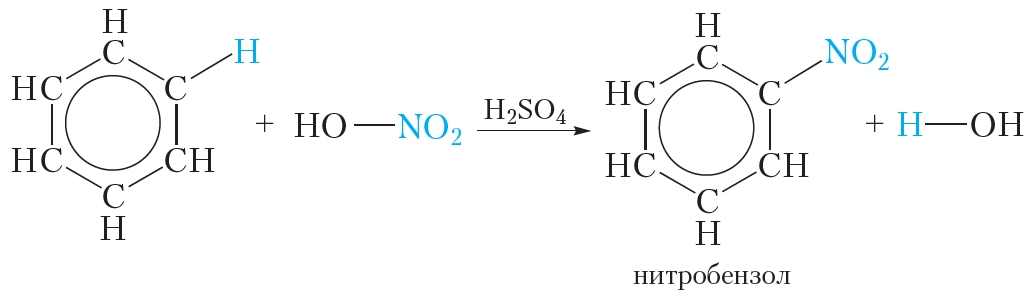С чем бензол вступает в реакцию замещения
с чем взаимодействует бензол и их уравнения реакции
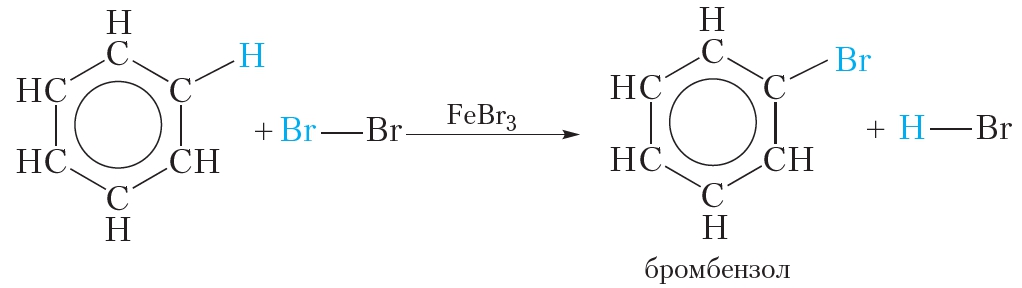
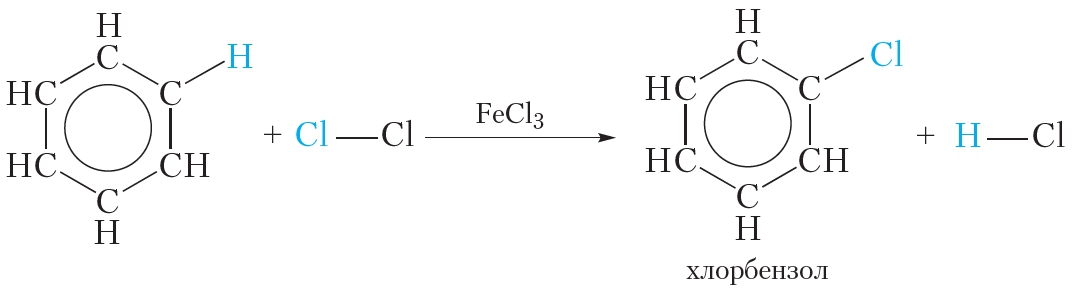
аиболее характерны для них реакции замещения атомов водорода бензольного ядра. Они протекают легче, чем у предельных углеводородов. Таким путем получают множество органических соединений. Так, при взаимодействии бензола с бромом (в присутствии катализатора FеВr2) атом водорода замещается атомом брома:
При другом катализаторе можно все атомы водорода в бензоле заместить на галоген. Это происходит, например, при пропускании в бензол хлора в присутствии хлорида алюминия:
В молекуле бензола можно заместить атом водорода на алкильный радикал действием галогенопроизводных углеводородов в присутствии хлорида алюминия:
При ультрафиолетовом облучении бензол присоединяет хлор:
Бензол не присоединяет галогеноводороды и воду. Он очень устойчив к окислителям. В отличие от непредельных углеводородов он не обесцвечивает бромную воду и раствор KMnO4. В обычных условиях бензольное кольцо не разрушается и при действии многих других окислителей. Однако гомологи бензола подвергаются окислению легче предельных углеводородов. При этом окислению подвергаются лишь радикалы, связанные с бензольным кольцом:
Таким образом, ароматические углеводороды могут вступать как в реакции замещения, так и в реакции присоединения, однако условия этих превращений значительно отличаются от аналогичных превращений предельных и непредельных углеводородов.
Реакция превращения циклогексана в бензол (дегидрогенизация или дегидрирование) протекает при пропускании его над катализатором (платиновой чернью) при 300°С. Предельные углеводороды реакцией дегидрогенизации также можно превращать в ароматические. Например:
Реакции дегидрирования позволяют использовать углеводороды нефти для получения углеводородов ряда бензола. Они указывают на связь между различными группами углеводородов и на взаимное превращение их друг в друга.
По способу Н. Д. Зелинского и Б. А. Казанского бензол можно получить, пропуская ацетилен через нагретую до 600° С трубку с активированным углем. Весь процесс полимеризации трех молекул ацетилена можно изобразить схемой
Бензол и его гомологи
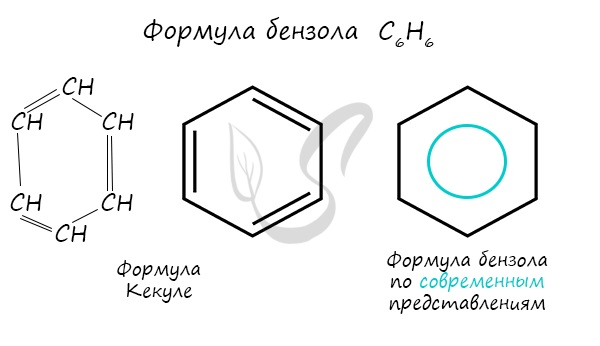
Важно заметить, что двойные связи в молекуле бензола не фиксированы, а постоянно перемещаются по кругу.
Долгое время структурная формула бензола оставалась тайной. Предложенная Кекуле формула с тремя двойными связями не могла объяснить то, что бензол не вступает в реакции присоединения. Как уже было сказано выше, по современным представлениям двойные связи в молекуле бензола постоянно перемещаются, поэтому более верно рисовать их в виде кольца.
Номенклатура и изомерия аренов
Для аренов характерна структурная изомерия, связанная с положением заместителей. Например, два заместителя в бензольном кольце могут располагаться в разных положениях.
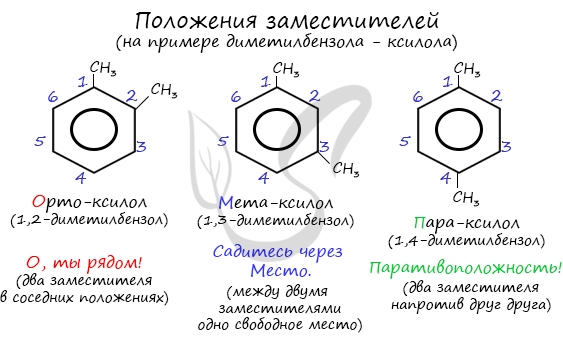
Название положения заместителей в бензольном кольце формируется на основе их расположения относительно друг друга. Оно обозначается приставками орто-, мета- и пара. Ниже вы найдете мнемонические подсказки для их успешного запоминания 😉
Получение аренов
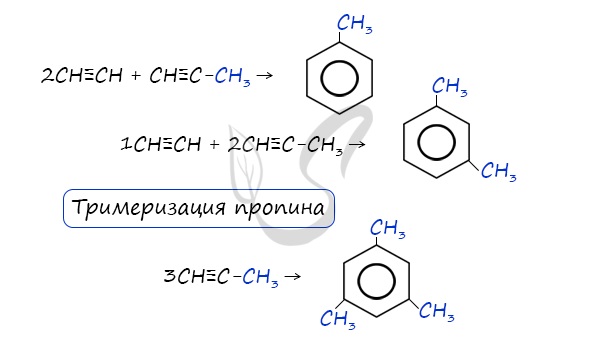
В случае, если к ацетилену добавить пропин, то становится возможным получение толуола. Увеличивая долю пропина, в конечном итоге можно добиться образования 1,3,5-триметилбензола.
При дегидроциклизации гептана получается толуол.
Синтез Дюма заключается в сплавлении солей карбоновых кислот с щелочами. В результате такой реакции возможно образование различных органических веществ, в том числе аренов.
Химические свойства аренов
Запомните, что, в отличие от других непредельных соединений, бензол и его гомологи не обесцвечивают бромную воду и раствор перманганата калия.
При повышенной температуре и наличии катализатора, водород способен разорвать двойные связи в бензольном кольце и превратить арен в циклоалкан.
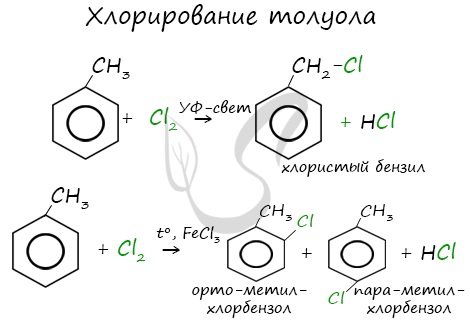
Реакция бензола с хлором на свету приводит к образованию гексахлорциклогексана, если же использовать только катализатор, то образуется хлорбензол.
Реакции с толуолом протекают иначе: при УФ-свете хлор направляется в радикал метил и замещает атом водорода в нем, при действии катализатора хлор замещает один атом водорода в бензольном кольце (в орто- или пара-положении).
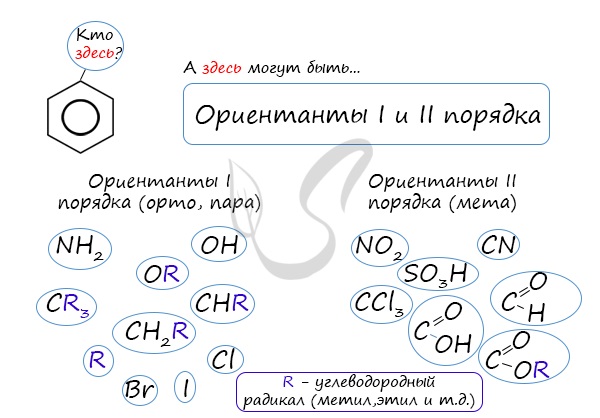
Почему хлор направляется именно в орто- и пара-положения относительно метильной группы? Здесь самое время коснуться темы ориентантов I (орто-, пара-ориентантов) и II порядков (мета-ориентанты).
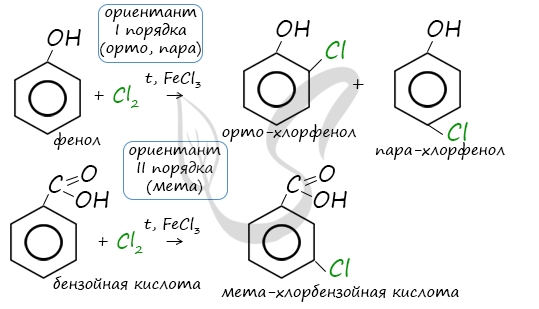
К ориентантам первого порядка относятся группы: NH2, OH, OR, CR3, CHR2, CH2R, галогены. К ориентантам второго: NO2, CN, SO3H, CCl3, CHO, COOH, COOR.
Например, ориентант I порядка, гидроксогруппа OH, обеспечивает протекание хлорирования в орто- и пара-положениях. А карбоксильная группа COOH, ориентант II порядка, обуславливает хлорирование в мета-положениях.
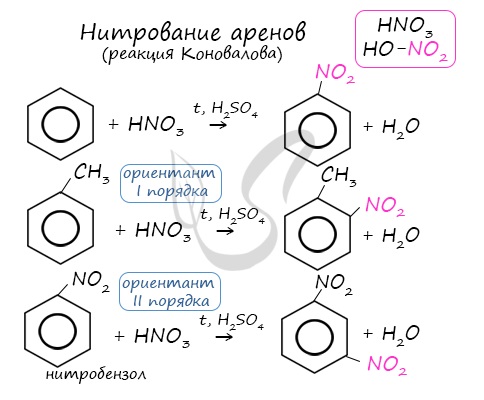
Арены вступают в реакции нитрования, протекающие при повышенной температуре и в присутствии серной кислоты, обладающей водоотнимающими свойствами.
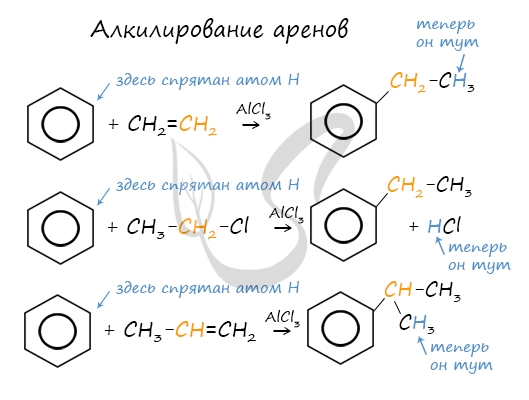
Алкилирование аренов осуществляется путем введения алкильного радикала в молекулу бензола. Алкильным радикалом чаще всего выступает алкен или галогеналкан. В подобных реакциях используют катализатор AlCl3.
В случае если для алкилирования используется алкен, то с молекулой бензола соединяется наименее гидрированный атом углерода алкена, прилежащий к двойной связи. Один атом водорода переходит из бензольного кольца к радикалу.
Арены, как и все органические вещества, сгорают с образованием углекислого газа и воды.
При неполном окислении гомологи бензола способны окисляться до бензойной кислоты (при подкислении раствора серной кислотой). Сам бензол не вступает в реакцию окисления с KMnO4, не обесцвечивает его раствор.
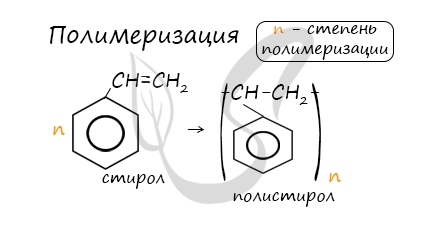
В реакцию полимеризации способен вступать стирол (винилбензол), в радикале которого содержится двойная связь.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Химия. 10 класс
§ 20. Химические свойства, получение и применение бензола
Химические свойства бензола
Как вы уже знаете, в молекуле бензола имеется устойчивая сопряжённая система π-связей. Поэтому для бензола характерны реакции замещения, так как в этих реакциях сопряжённая система сохраняется. Наоборот, реакции присоединения для бензола малохарактерны. Так, бензол не обесцвечивает бромную воду, но в присутствии катализатора он вступает с бромом в реакцию замещения.
1. Галогенирование
Для осуществления этой реакции бензол смешивают с бромом в колбе и добавляют катализатор FeBr3. При этом протекает реакция замещения одного атома водорода на бром:
О протекании реакции можно судить по выделению бромоводорода, изменяющего цвет влажной индикаторной бумажки, помещённой в верхнюю часть колбы. Продукт бромирования бензола называется бромбензол.
Как видно, в этой реакции единая система π-электронов сохраняется. Подобным образом проводят и хлорирование бензола:
2. Нитрование
Так называются реакции, в результате которых в молекулу органического соединения вводится группа — NO2, называемая нитрогруппой.
Если к смеси концентрированных азотной и серной кислот прибавить бензол, происходит реакция нитрования бензола, в результате которой образуется тяжёлая желтоватая жидкость с запахом горького миндаля — нитробензол:

Смесь концентрированных азотной и серной кислот называется нитрующей смесью. В нитрующей смеси азотная кислота выполняет роль нитрующего реагента, а серная кислота является катализатором.
С нитрованием гомолога бензола — толуола, продуктом которого является взрывчатое вещество, вы можете познакомиться, перейдя по ссылке в QR-коде.
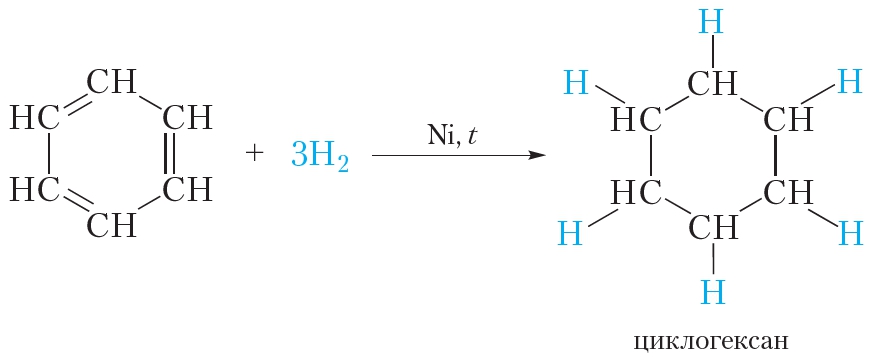
3. Гидрирование
В жёстких условиях бензол может вступать в реакции присоединения. Примером реакции присоединения с участием бензола является его гидрирование, которое протекает при температуре около 200 °С под давлением в присутствии катализаторов гидрирования (никель или платина). При этом одна молекула бензола присоединяет сразу три молекулы водорода и превращается в циклогексан:

С реакцией присоединения хлора к бензолу вы можете познакомиться, перейдя по ссылке в QR-коде.
4. Горение
Подобно всем углеводородам, бензол горит. Уравнение реакции горения бензола:
С чем бензол вступает в реакцию замещения
Бензол и его производные
Примеры реакций электрофильного замещения
Гомологи бензола вступают в реакции электрофильного замещения легче, чем бензол, из-за электронодонорного влияния алкильных заместителей. В результате монозамещения образуются, как правило, все три изомера с преобладанием орто— и пара-продуктов.
Для введения галогена в ароматическое кольцо в качестве реагентов используют комплексы галогенов с кислотами Льюиса. Роль последних заключается в поляризации связи галоген-галоген, в результате чего один из атомов приобретает положительный заряд, тогда как другой образует связь с кислотой Льюиса за счет ее вакантной d-орбитали.
На практике вместо безводного бромида алюминия часто применяют железные стружки. При добавлении в реакционный сосуд галогена (хлора или брома) железо превращается в галогенид железа(III), который является сильной кислотой Льюиса и тоже катализирует реакцию.
Скорость реакции галогенирования зависит от электроотрицательности галогена и π-избыточности арена. Так, лишь для немногих субстратов удается провести электрофильное иодирование, тогда как фторирование зачастую сопровождается разрывом связей С-С. По этой причине путь электрофильного замещения водорода применяется, в основном, для синтеза бром- и хлораренов. Хлор активнее брома, поэтому электроноизбыточные ароматические соединения реагирует без катализатора. Для бромирования алкилбензолов и собственно бензола катализ необходим, тогда как ариламины и эфиры фенолов бромируются в мягких условиях. Во всех этих реакциях электрофильного замещения галоген вступает в положение с наибольшей электронной плотностью, соответственно правилам ориентации.
Некоторые субстраты бромируют в условиях свободно-радикальной реакции. Для этого используются такие реагенты, как N-бром- и N-хлорсукцинимид (N-галогенированные имиды янтарной кислоты), либо добавляется активатор типа AIBN или перекиси бензоила. Свободно-радикальные реакции не отличаются высокой избирательностью и ориентация радикального галогенирования зачастую сильно отличается от электрофильного.
Можно нитровать азотной кислотой без применения серной, но реакция идет медленнее, т.к. равновесие смещено влево. Еще медленнее реакция идет, когда азотную кислоту используют в растворах уксусной кислоты, нитрометана и т.д., поэтому такие условия применяют для нитрования соединений с повышенной активностью.
В результате атаки триоксида серы образуется σ-комлекс, который представляет собой биполярную нейтральную частицу. Вероятно, поэтому, в отличие от других реакций электрофильного замещения, где σ-комплекс положительно заряжен, в этом случае медленной стадией является не образование σ-комплекса, а отщепление протона и реароматизация.
При сульфировании серной кислотой катион гидросульфоксония образуется в результате следующей обменной реакции:
Образующийся при сульфировании серной кислотой заряженный σ-комплекс находится в равновесии с нейтральным σ-комплексом. Это объясняет тот факт, что скорость реакции и в этом случае определяется скоростью стадии реароматизации.
Реакция сульфирования обратима. Это подтверждается тем, что выход бензолсульфокислоты увеличивается, если при проведении реакции производится азеотропная отгонка воды избытком бензола. Кроме того, нагревание аренсульфокислот с 25-50%-ной серной кислотой приводит к удалению сульфогруппы.
Поэтому сульфирование зачастую применяют для защиты определенного положения в ядре в многостадийных синтезах, например:
Алкилирование по Фриделю-Крафтсу
Одним из способов получения гомологов бензола является реакция алкилирования. Превращение носит имя Ш. Фриделя и Дж. М. Крафтса, которые его открыли. В реакцию, как правило, вводят галогеналканы и галогениды алюминия в качестве катализаторов. Считают, что катализатор – кислота Льюиса – поляризует связь С-галоген, создавая на атоме углерода дефицит электронной плотности, т.е. механизм аналогичен реакции галогенирования
Этот углеродный атом является электрофилом, и атакует молекулу арена. При планировании синтеза Фриделя-Крафтса очень важно учитывать строение алкильного радикала, который предполагается ввести в ароматическую молекулу. Природа алкилов, входящих в комплекс с кислотой Льюиса, близка к катионной. Известно, что устойчивость карбокатионов зависит от их структуры и падает в ряду третичный > вторичный > первичный. Поэтому при электрофильном алкилировании может происходить и часто происходит перегруппировка промежуточных катионов в более устойчивые: первичных во вторичные и третичные, вторичных – в третичные. Так, взаимодействие 1-хлорпропана с хлоридом алюминия может быть представлено одной из схем
Именно такой перегруппировкой объясняется то, что при попытке синтеза н-пропилбензола из бензола и 1-хлорпропана получают изопропилбензол (кумол).
Для алкилирования аренов не обязательно применять галогеналканы. В реакции могут использоваться алканолы и алкены, этиленоксид; из них также генерируются карбокатионы при действии сильных протонных и льюисовских кислот.
Ацилирование по Фриделю-Крафтсу
Сходной с реакцией алкилирования является реакция ацилирования ароматических соединений. В качестве реагентов применяют ангидриды или галогенангидриды карбоновых кислот, продуктами являются ароматические кетоны. Механизм этой реакции включает образование комплексного соединения между ацилирующим реагентом и кислотой Льюиса. В результате положительный заряд на атоме углерода несравненно возрастает, что делает его способным к атаке ароматического соединения.
Нужно отметить, что, в отличие от реакции алкилирования, в данном случае необходимо брать избыток катализатора по отношению к количеству реагентов, т.к. продукт реакции (кетон) сам способен к комплексообразованию и связывает кислоту Льюиса.
Арены (ароматические углеводороды)
Арены (ароматические углеводороды) – это непредельные (ненасыщенные) циклические углеводороды, молекулы которых содержат устойчивые циклические группы атомов (бензольные ядра) с замкнутой системой сопряженных связей.
Общая формула: CnH2n–6 при n ≥ 6.
Строение аренов
Рассмотрим подробно строение молекулы бензола. В ней присутствуют три двойные связи С=С, три одинарные связи С–C и шесть одинарных связей С–Н.
Структурная формула бензола:
Сокращенная структурная формула бензола:
Каждый атом углерода в молекуле бензола связан с двумя соседними атомами углерода и атомом водорода тремя σ-связями. Валентные углы равны 120 0 :
| Атомы углерода и водорода в молекуле бензола, соединенные σ-связями, образуют правильный шестиугольник, в котором все атомы углерода и все σ-связи С–С и С–Н лежат в одной плоскости. |
| Негибридные р-орбитали атомов углерода образуют единую циклическую (ароматическую) π-систему – единое электронное облако над и под плоскостью кольца. |
Соответственно, на самом деле все связи между атомами углерода в молекуле бензола одинаковой длины (0,140 нм), что соответствует промежуточному значению между одинарной и двойной (полуторная связь).
Соответственно, в молекуле бензола между углеродными атомами нет обычных одинарных и двойных связей, а все они выравнены (делокализованы).
| Поэтому структурную формулу бензола изображают в виде правильного шестиугольника и кружка внутри него, который обозначает делокализованные π-связи: |
Гомологический ряд аренов
Простейший представитель гомологического ряда аренов — бензол:
Ближайший гомолог бензола – толуол (метилбензол):
Еще один представитель гомологического ряда бензола – этилбензол:
Изопропилбензол (кумол):
Номенклатура аренов
Первый представитель гомологического ряда аренов — бензол:
Ближайший гомолог бензола – толуол (метилбензол):
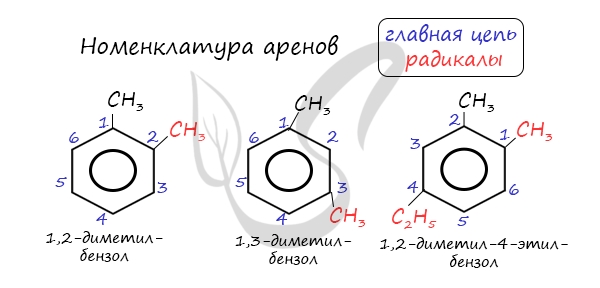
При составлении названия ароматического соединения за главную цепь принимают молекулу бензола. Если в ароматическом кольце несколько заместителей, то атомы углерода бензольного кольца нумеруются: в направлении, где больше заместителей, от самого главного заместителя (чем больше атомов углерода в радикале, тем он старше).
| Например, 1,2-диметилбензол |
Если в молекуле бензола присутствуют два заместителя, то также используют систему специальных приставок:
Для названия многих производных бензола используют тривиальные названия:
| Структурная формула | Системное название | Тривиальное название |
 | Метилбензол | Толуол |
 | 1,2-Диметилбензол | орто-Ксилол |
 | Изопропилбензол | Кумол |
Названия радикалов, содержащих ароматическое кольцо:
Изомерия аренов
Структурная изомерия
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Формуле С9Н12 соответствуют изомеру изопропилбензол и пропилбензол
| Изопропилбензол | Пропилбензол |
 |  |
Формуле С9Н12 соответствуют изомеру изопропилбензол и пропилбензол
| Изопропилбензол | Пропилбензол |
 |  |
Химические свойства аренов
Арены – непредельные углеводороды, молекулы которых содержат три двойных связи и цикл. Но из-за эффекта сопряжения свойства аренов отличаются от свойств других непредельных углеводородов.
Для ароматических углеводородов характерны реакции:
| Бензольное кольцо представляет из себя скопление π-электронов, которое притягивает электрофилы. Поэтому для ароматических углеводородов характерны реакции электрофильного замещения атома водорода у бензольного кольца. |
Ароматическая система бензола устойчива к действию окислителей. Однако гомологи бензола окисляются под действием перманганата калия и других окислителей.
1. Реакции присоединения
Бензол присоединяет хлор на свету и водород при нагревании в присутствии катализатора.
1.1. Гидрирование
Бензол присоединяет водород при нагревании и под давлением в присутствии металлических катализаторов (Ni, Pt и др.).
При гидрировании бензола образуется циклогексан:
При гидрировании гомологов образуются производные циклоалканы. При нагревании толуола с водородом под давлением и в присутствии катализатора образуется метилциклогексан:
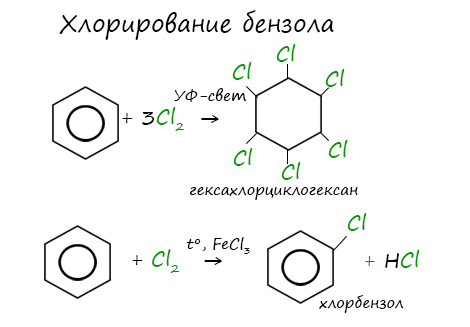
1.2. Хлорирование аренов
Присоединение хлора к бензолу протекает по радикальному механизму при высокой температуре, под действием ультрафиолетового излучения.
При хлорировании бензола на свету образуется 1,2,3,4,5,6-гексахлорциклогексан (гексахлоран).
Гексахлоран – пестицид, использовался для борьбы с вредными насекомыми. В настоящее время использование гексахлорана запрещено.
Гомологи бензола не присоединяют хлор. Если гомолог бензола реагирует с хлором или бромом на свету или при высокой температуре (300°C), то происходит замещение атомов водорода в боковом алкильном заместителе, а не в ароматическом кольце.
| Например, при хлорировании толуола на свету образуется бензилхлорид |
| Если у гомолога бензола боковая цепь содержит несколько атомов углерода – замещение происходит у атома, ближайшему к бензольному кольцу («альфа-положение»). |
| Например, этилбензол реагирует с хлором на свету |
2. Реакции замещения
| Реакции замещения у ароматических углеводородов протекают по ионному механизму (электрофильное замещение). При этом атом водорода замещается на другую группу (галоген, нитро, алкил и др.). |
2.1. Галогенирование
Бензол и его гомологи вступают в реакции замещения с галогенами (хлор, бром) в присутствии катализаторов (AlCl3, FeBr3).
При взаимодействии с хлором на катализаторе AlCl3 образуется хлорбензол:
Бром реагирует с железом с образованием бромида железа (III), который катализирует процесс бромирования бензола:
| Гомологи бензола содержат алкильные заместители, которые обладают электронодонорным эффектом: из-за того, что электроотрицательность водорода меньше, чем углерода, электронная плотность связи С-Н смещена к углероду. На нём возникает избыток электронной плотности, который далее передается на бензольное кольцо. |
| Поэтому гомологи бензола легче вступают в реакции замещения в бензольном кольце. При этом гомологи бензола вступают в реакции замещения преимущественно в орто— и пара-положения |
| Например, при взаимодействии толуола с хлором образуется смесь продуктов, которая преимущественно состоит из орто-хлортолуола и пара-хлортолуола |
Мета-хлортолуол образуется в незначительном количестве.
При взаимодействии гомологов бензола с галогенами на свету или при высокой температуре (300 о С) происходит замещение водорода не в бензольном кольце, а в боковом углеводородном радикале.
| Если у гомолога бензола боковая цепь содержит несколько атомов углерода – замещение происходит у атома, ближайшему к бензольному кольцу («альфа-положение»). |
Например, при хлорировании этилбензола:
2.2. Нитрование
Бензол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты (нитрующая смесь).
При этом образуется нитробензол:
| Серная кислота способствует образованию электрофила NO2 + : |
Толуол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты.
В продуктах реакции мы указываем либо о-нитротолуол:
Нитрование толуола может протекать и с замещением трех атомов водорода. При этом образуется 2,4,6-тринитротолуол (тротил, тол):
2.3. Алкилирование ароматических углеводородов
| Например, бензол реагирует с пропиленом с образованием изопропилбензола (кумола) |
2.4. Сульфирование ароматических углеводородов
Бензол реагирует при нагревании с концентрированной серной кислотой или раствором SO3 в серной кислоте (олеум) с образованием бензолсульфокислоты:
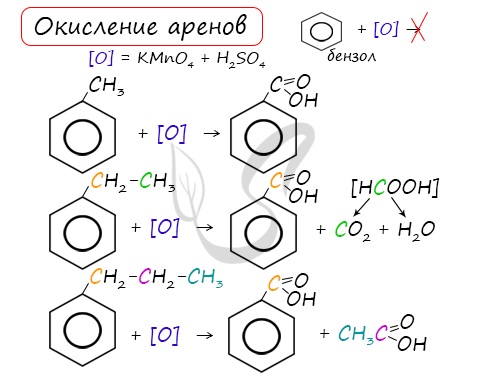
3. Окисление аренов
Бензол устойчив к действию даже сильных окислителей. Но гомологи бензола окисляются под действием сильных окислителей. Бензол и его гомологи горят.
3.1. Полное окисление – горение
При горении бензола и его гомологов образуются углекислый газ и вода. Реакция горения аренов сопровождается выделением большого количества теплоты.
Уравнение сгорания аренов в общем виде:
При горении ароматических углеводородов в недостатке кислорода может образоваться угарный газ СО или сажа С.
Бензол и его гомологи горят на воздухе коптящим пламенем. Бензол и его гомологи образуют с воздухом и кислородом взрывоопасные смеси.
3.2. О кисление гомологов бензола
Гомологи бензола легко окисляются перманганатом и дихроматом калия в кислой или нейтральной среде при нагревании.
При этом происходит окисление всех связей у атома углерода, соседнего с бензольным кольцом, кроме связи этого атома углерода с бензольным кольцом.
Толуол окисляется перманганатом калия в серной кислоте с образованием бензойной кислоты:
Если окисление толуола идёт в нейтральном растворе при нагревании, то образуется соль бензойной кислоты – бензоат калия:
Таким образом, толуол обесцвечивает подкисленный раствор перманганата калия при нагревании.
| При окислении других гомологов бензола всегда остаётся только один атом С в виде карбоксильной группы (одной или нескольких, если заместителей несколько), а все остальные атомы углерода радикала окисляются до углекислого газа или карбоновой кислоты. |
| Например, при окислении этилбензола перманганатом калия в серной кислоте образуются бензойная кислота и углекислый газ |
| Например, при окислении этилбензола перманганатом калия в нейтральной кислоте образуются соль бензойной кислоты и карбонат |
Более длинные радикалы окисляются до бензойной кислоты и карбоновой кислоты:
При окислении пропилбензола образуются бензойная и уксусная кислоты:
Изопропилбензол окисляется перманганатом калия в кислой среде до бензойной кислоты и углекислого газа:
4. Ориентирующее действие заместителей в бензольном кольце
Если в бензольном кольце имеются заместители, не только алкильные, но и содержащие другие атомы (гидроксил, аминогруппа, нитрогруппа и т.п.), то реакции замещения атомов водорода в ароматической системе протекают строго определенным образом, в соответствии с характером влияния заместителя на ароматическую π-систему.
| Заместители подразделяют на две группы в зависимости от их влияния на электронную плотность ароматической системы: электронодонорные (первого рода) и электроноакцепторные (второго рода). |
Типы заместителей в бензольном кольце
| Например, толуол реагирует с хлором в присутствии катализатора с образованием смеси продуктов, в которой преимущественно содержатся орто-хлортолуол и пара-хлортолуол. Метильный радикал — заместитель первого рода. |
В уравнении реакции в качестве продукта записывается либо орто-хлортолуол, либо пара-хлортолуол.
| Например, при бромировании нитробензола в присутствии катализатора преимущественно образуется мета-бромтолуол. Нитро-группа — заместитель второго рода |

5. Особенности свойств стирола
Стирол (винилбензол, фенилэтилен) – это производное бензола, которое имеет в своем составе двойную связь в боковом заместителе.
Общая формула гомологического ряда стирола: CnH2n-8.
| Молекула стирола содержит заместитель с кратной связью у бензольного кольца, поэтому стирол проявляет все свойства, характерные для алкенов – вступает в реакции присоединения, окисления, полимеризации. |
Стирол присоединяет водород, кислород, галогены, галогеноводороды и воду в соответствии с правилом Марковникова.
| Например, при гидратации стирола образуется спирт: |
| Стирол присоединяет бром при обычных условиях, то есть обесцвечивает бромную воду |
При полимеризации стирола образуется полистирол:
Как и алкены, стирол окисляется водным раствором перманганата калия при обычных условиях. Обесцвечивание водного раствора перманганата калия — качественная реакция на стирол:
При жестком окислении стирола перманганатом калия в кислой среде (серная кислота) разрывается двойная связь и образуется бензойная кислота и углекислый газ:
При окислении стирола перманганатом калия в нейтральной среде при нагревании также разрывается двойная связь и образуется соль бензойной кислоты и карбонат:
Получение аренов
1. Реакция Вюрца-Фиттига
Хлорбензол реагирует с хлорметаном и натрием. При этом образуется смесь продуктов, одним из которых является толуол:
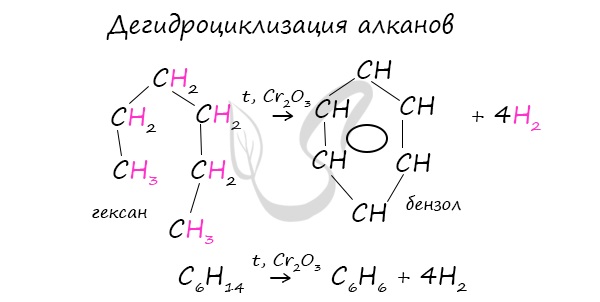
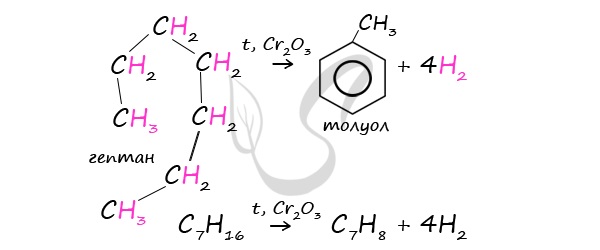
2. Дегидроциклизация алканов
Алканы с углеродной цепью, содержащей 6 и более атомов углерода в главной цепи, при дегидрировании образуют устойчивые шестиатомные циклы, т. е. циклогексан и его гомологи, которые далее превращаются в ароматические углеводороды.
Гексан при нагревании в присутствии оксида хрома (III) в зависимости от условий может образовать циклогексан и потом бензол:
Гептан при дегидрировании в присутствии катализатора образует метилциклогексан и далее толуол:
3. Дегидрирование циклоалканов
При дегидрировании циклогексана и его гомологов при нагревании в присутствии катализатора образуется бензол или соответствующие гомологи бензола.
| Например, при нагревании циклогексана в присутствии палладия образуется бензол и водород |
| Например, при нагревании метилциклогексана в присутствии палладия образуется толуол и водород |
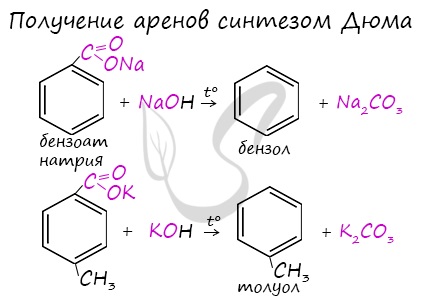
4. Декарбоксилирование солей бензойной кислоты
Реакция Дюма — это взаимодействие солей карбоновых кислот с щелочами при сплавлении.
R–COONa + NaOH → R–H + Na2CO3
Декарбоксилирование — это отщепление (элиминирование) молекулы углекислого газа из карбоксильной группы (-COOH) или органической кислоты или карбоксилатной группы (-COOMe) соли органической кислоты.
Взаимодействие бензоата натрия с гидроксидом натрия в расплаве протекает аналогично реакции получения алканов по реакции Дюма с образованием бензола и карбоната натрия:
5. Алкилирование бензола и его гомологов
| Например, бензол реагирует с пропиленом с образованием изопропилбензола (кумола) |
6. Тримеризация ацетилена
При нагревании ацетилена под давлением над активированным углем молекулы ацетилена соединяются, образуя бензол.
При тримеризации пропина образуется 1,3,5-триметилбензол.
7. Получение стирола
Стирол можно получить дегидрированием этилбензола:
Стирол можно также получить действием спиртового раствора щелочи на продукт галогенирования этилбензола (1-хлор-1-фенилэтан):