С чего целесообразно начинать изучение строения атома в 11 классе
Урок по химии на тему «Строение атома» (11 класс)
1. Рассмотреть современные представления о строении атома. Дать важнейшие химические понятия: «хим. элемент», «изотопы». Научить учащихся определять состав и строение атома элемента по его положению в ПСХЭ.
2. Развивать внимание, память, речь, аналитическое мышление, способность делать выводы.
3. Воспитывать любовь к предмету.
Метод: рассказ с элементами беседы
1.Представления о строении атома.
2. Доказательства сложной структуры атома.
6. Корпускулярно-волновой дуализм.
Понятие «атом» возникло и оформилось как система представлений об устройстве окружающего мира в воззрениях древнегреческих философов в 500-200 гг. до н.э. Левкипп утверждал, что мир состоит из мельчайших частиц и пустоты. Демокрит назвал эти частицы атомами и считал, что они вечно существуют и способны двигаться. Форма, внешнее различие атомов. как считалось, придают определённые свойства телам. Например, атомы воды – гладкие, они способны перекатываться, и поэтому жидкости свойственна текучесть; атомы железа имеют зубчики, которыми они закрепляются друг за друга, что придаёт железу свойства твёрдого тела. Способность атомов самостоятельно взаимодействовать друг с другом была предложена Эпикуром .
Затем, в течение почти 20 столетий, учение об атомном строении окружающего мира не получило развития и было предано забвению.
В начале XIX в . Дж. Дальтон возродил атомистическую теорию. Он установил, что атомы одного и того же хим. элемента имеют одинаковые свойства, а разным элементам соответствуют разные атомы. Была введена важнейшая характеристика атома – атомная масса, относительные значения которой были установлены для ряда элементов. Однако атом по-прежнему считался неделимой частицей.
В конце XIX и в начале XX вв. появились экспериментальные доказательства сложной структуры атома :
— фотоэффект – явление, когда при освещении металлов с их поверхности испускаются носители электрического заряда ( А.Г. Столетов, 1889 г.);
— катодные лучи – поток отрицательно заряженных частиц–электронов в вакуумированной трубке, содержащей анод и катод (Дж. Томсон, 1897 г.);
— рентгеновские лучи – электромагнитное излучение, подобное видимому свету, но с гораздо более высокой частотой, испускаемое веществами при сильном воздействии на них катодных лучей;
— радиоактивность – явление самопроизвольного превращения одного хим. элемента в другой, сопровождающееся испусканием электронов, положительно заряженных частиц, других элементарных частиц и рентгеновского излучения ( А. Беккерель, М. Складовская-Кюри, 1896-189 гг.)
Как же развивалась классическая теория строения атома?
Гипотеза Дж. Томсона.
В этой модели атом уподоблен сферической капле с положительным зарядом. Внутрь сферы вкраплены отрицательно заряженные электроны, которые совершают колебательные движения в связи с чем атом излучает электромагнитную энергию. Атом в целом нейтрален.
Модель атома Дж. Томсона не была подтверждена экспериментальными фактами и осталась гипотезой.
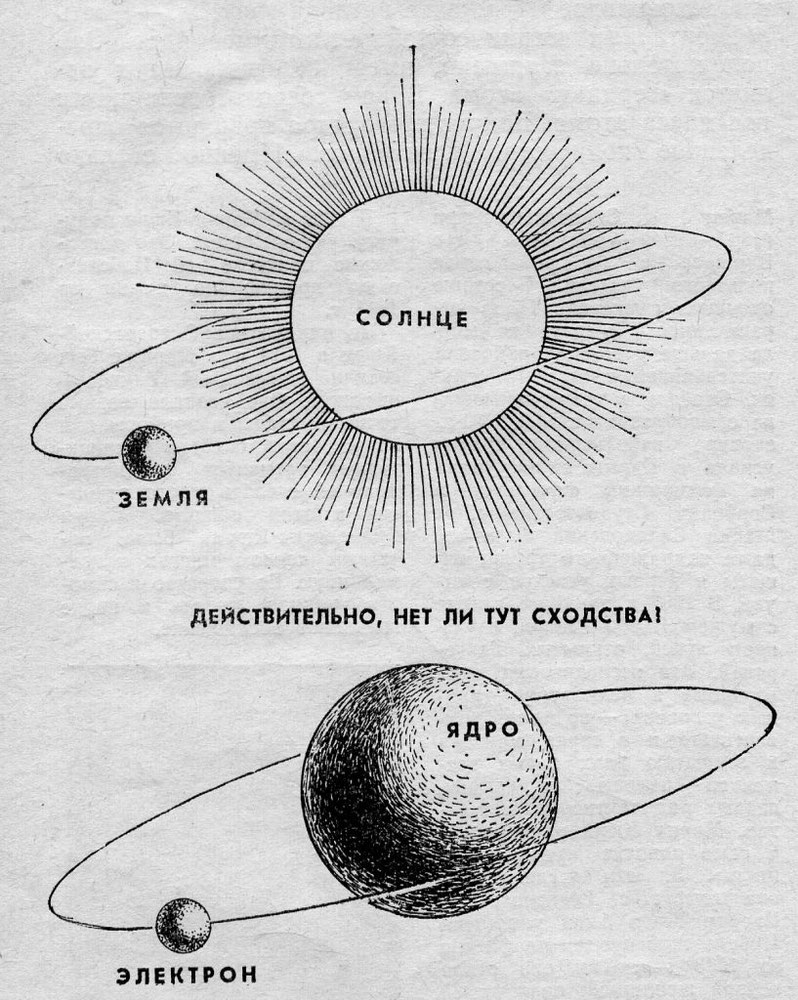
Планетарная модель Э.Резерфорда (1911 г).
Атом состоит из положительно заряженного ядра и электронов, вращающихся вокруг ядра по замкнутым орбитам подобно движению планет вокруг Солнца. Этой моделью мы пользуемся и сейчас. Но теория Э.Резерфорда не могла объяснить излучение и поглощение энергии атомом.
Квантовые постулаты Н.Бора (1913 г).
Опирались на теоретические идеи М.Планка (1900г) и А.Эйнштейна (1905г).
Основные положения своей теории Бор сформулировал в виде постулатов – утверждений, принимаемых без доказательства, содержание которых сводится к следующему:
Двигаясь по стационарной орбите ē не излучает электромагнитной энергии (и не поглощает её).
Излучение происходит при скачкообразном переходе ē с одной стационарной орбиты на другую. При этом испускается или поглощается квант электромагнитного излучения, энергия которого равна разности энергии атома в конечном и исходном состояниях.
Постулаты Бора находились в резком противоречии с положениями классической физики. С точки зрения классической механики ē может вращаться по любым орбиталям, а классическая электродинамика не допускает движения заряженной частицы по круговой орбите без излучения. Но эти постулаты нашли своё оправдание в замечательных результатах, полученных Бором при расчёте спектра атома водорода.
Итак, по Резерфорду, атом состоит из «+» ядра и «-» электронов. Заряд ядра численно совпадает с порядковым номером элемента в ПС. «-» заряд ē принят за единицу. Т.к. атом в целом электронейтрален, то зн. число ē равно заряду ядра, т.е. лорядковому номеру элемента.
Na +11 11 ē ; К +19 19 ē ; Mn +25 25 ē ;
Порядковый номер хим. элемента совпадает с зарядом ядра его атома.
Класс: 11
Презентация к уроку
Цель урока: Расширить знания учащихся по теме, доказать ядерную модель атома с помощью опытов Резерфорда, показать недостатки данной модели. (слайд 2)
Проблема строения атома остается актуальной и для современной науки. Элементарные частицы, ядро атома, атом, молекула – все это объекты микромира, не наблюдаемого нами. В нем действуют иные законы, чем в макромире, объекты которого мы можем наблюдать или непосредственно, или с помощью приборов.
Изложение нового материала.
В истории развития физики одна из самых интересных и увлекательных страниц – это история открытия сложного строения атома. В конце XIX- начале XX в. идеи о строении атома витали в воздухе, различные догадки ученых создавали духовную атмосферу, в которой, в конце концов, и рождалось открытие, ведь в то время ничего о внутреннем строении атома не было известно.
Сообщение ученика 1: Гипотеза о существовании атомов так же стара, как и наша цивилизация. Понятие атома существует уже по крайней мере 25 столетий.
Демокрит (460-370 гг. до н.э.). Демокрит происходил из богатого и знаменитого рода в Северной Греции. Все доставшиеся ему в наследство деньги он потратил на путешествия. За это его осудили: по греческим законам растрата отцовского имущества являлась серьезным преступлением. Но он был оправдан, так как ему удалось доказать, что в своих путешествиях он приобрел обширные знания. В конечном счете, горожане признали Демокрита мудрецом и выделили денежное содержание, которое позволило ему продолжать научные занятия. Основные элементы его картины природы таковы:
— Все тела состоят из атомов, которые неделимы и имеют неизменную форму.
— Число атомов бесконечно, число различных типов атомов тоже бесконечно.
— Атомы обладают различными выступами, углублениями и крючками, позволяющими им сцепляться друг с другом и тем самым образовывать устойчивые соединения. Философ был настолько убежденным атомистом, что даже человеческую душу представлял в виде комбинации атомов.
В России идеи о мельчайших частицах вещества развивал Михаил Васильевич Ломоносов (1711-1765).
Различая два вида частиц материи, он дает им названия “элементы” (равные понятию “атом”) и “корпускулы” (равные понятию “молекула”). По Ломоносову, “элемент есть часть тела, не состоящая из каких-либо других меньших частиц”, а “корпускула есть собрание элементов в одну небольшую массу”.
Английский ученый Джон Дальтон (1766-1844) впервые предпринял попытку количественного описания свойств атомов. Именно им было введено понятие атомной массы и составлена первая таблица относительных атомных масс различных химических элементов. При этом атом представляется как мельчайшая неделимая, то есть бесструктурная, частица вещества.
К концу 90-х годов 19 века было прочно установлено, что в состав вещества входят отрицательно и положительно заряженные частицы. Особенную роль в этом сыграло открытие катодных лучей и изучение их свойств.
Сообщение ученика 2: (слайд 6) Чтобы определить природу катодных лучей, английский физик Джозеф Джон Томсон (1856-1940) проводит эксперимент, в ходе которого обнаружил, что катодные лучи ведут себя как отрицательно заряженные частицы: “Поскольку катодные лучи несут отрицательный заряд, отклоняются под действием электростатической силы, как если бы они были отрицательно заряженными, и реагируют на магнитную силу точно так же, как реагировали бы на неё отрицательно заряженные тела, двигавшиеся вдоль линии распространения лучей, я не могу не прийти к заключению, что катодные лучи суть заряды отрицательного электричества, переносимые частицами материи. Тогда встаёт вопрос: что это за частицы? Являются ли они атомами, молекулами или материей в более тонком состоянии разделения? С целью пролить некоторый свет на этот вопрос я провёл целый ряд измерений отношений массы этих частиц к величине заряда, переносимого ими”.
После открытия в 1897 году электрона, входящего в состав атома, был сделан вывод о сложном строении атома. Первая достаточно разработанная модель атома была предложена Томсоном. Согласно этой модели вещество в атоме несет положительный заряд и равномерно заполняет весь объем атома. Электроны “вкраплены” в атом, словно изюм в булку. (слайд 7)
Сообщение ученика 3:
Модель Томсона нуждалась в экспериментальной проверке. (слайд 8) Этой задачей занялся Эрнест Резерфорд (1871-1937 гг.) – английский ученый, известный своими исследованиями строения атома и радиоактивности, один из создателей атомной и ядерной физики. Резерфорд был членом Лондонского королевского общества – академии наук Англии, почетным членом более 30 академий и научных обществ разных стран мира, в том числе Академии наук СССР. В 1908 году он был лауреатом Нобелевской премии за исследования радиоактивности.
В лаборатории Резерфорда были проведены следующие эксперименты (слайд ). В качестве бомбардирующих частиц взяли тяжелые частицы, которые лучше всего подходили для изучения строения атома. Чтобы, по возможности, точнее исследовать единичные столкновения частиц с атомами мишени, было желательно, чтобы сама мишень была как можно тоньше. К счастью, золотая фольга обладает тем замечательным свойством, что путем расплющивания ее можно сделать исключительно тонкой, толщиной всего лишь в 400 атомов золота.
В ранних экспериментах исследовались малые углы рассеяния и было обнаружено, что практически все частицы проходили через мишень, не отклоняясь, как если бы атомы мишени были совершенно прозрачны для бомбардирующих частиц (угол отклонения порядка одного градуса).
Вопрос учащимся: как можно объяснить результаты опытов?
Ответ: Результаты опыта можно объяснить следующим образом. Альфа-частицы, проходя через фольгу, проходят сквозь атомы золота. Это возможно потому, что легкие электроны почти не влияют на движение тяжелой альфа-частицы. Так как альфа-частицы в большинстве случаев отклоняются на малые углы, атом в большей части своего объема пустой и лишь небольшую их часть занимает положительный заряд. Эта центральная часть атома получила название ядра. Из опытов следует, что ядро и отталкивает альфа-частицу, причем тем сильнее, чем ближе к ядру она проходит.
Противоречие 1. Согласно теории Максвелла, любой ускоренно движущийся заряд должен непрерывно излучать электромагнитные волны. Электроны, обращающиеся вокруг ядра, движутся с центростремительным ускорением и, следовательно, согласно максвелловской электродинамике, должны непрерывно излучать электромагнитные волны. Но в нормальном состоянии атомы не излучают!
Таким образом, факт длительного существования атомов несовместим с планетарной моделью атома Резерфорда, если ее рассматривать с позиции классической электродинамики.
В 1913 году датский физик Нильс Бор предпринял попытку создания качественно новой модели атома, но это тема следующего урока.
Отработка изученного материала.
А пока давайте вспомним, о чем мы говорили сегодня на уроке.
1. В чём заключается сущность модели Томсона?
2. В чём заключалась идея опыта Резерфорда?
3. Объясните по схеме опыт Резерфорда по рассеиванию альфа-частиц.
4. Объясните причину рассеивания альфа-частиц атомами вещества.
5. В чём сущность планетарной модели атома?
6. В чем противоречивость модели атома Резерфорда?
Вам предлагается выполнить тест по изученному материалу:
1. В атоме кремния 14 электронов. Выберите правильное утверждение.
А. В ядре атома кремния 14 частиц.
Б. В ядре атома кремния 14 протонов.
В. Масса положительного иона кремния больше массы атома кремния.
Г. Среди утверждений нет правильного.
2. Существуют ли атомные ядра с зарядом меньшим, чем у одного протона? Почему?
3. Является ли нейтральным атом гелия, если вокруг его ядра обращается один электрон?
4. В ядре атом серебра 107 частиц. Вокруг ядра обращаются 47 электронов. Сколько в ядре этого атома нейтронов и протонов?
5. В результате трения стеклянной палочки о шёлк ей сообщён положительный заряд. Объясните, все ли атомы, из которых состоит заряженная палочка, нейтральны. Почему? Изменилась ли масса стеклянной палочки после сообщения ей положительного заряда? Как? Почему?
Выводы. Домашнее задание.
Технологическая карта урока
Класс: 11
Презентация к уроку
Постулаты Н.Бора (слайд 1)
Ключевые слова: атомная физика, атом, Резерфорд, Томсон, эксперимент, модель атома, противоречия, Н.Бор, постулаты, стационарные орбиты, излучение, спектры.
Задачи:
Формы организации работы учащихся: индивидуальная, фронтальная, групповая,
Методы обучения: эвристический метод, исследовательский, объяснительно-репродуктивный, побуждающий
Формы обучения: эвристическая беседа, наглядные, практические (упражнения); фронтальная работа, самостоятельная работа, индивидуальные задания.
Девиз урока: “Нам необыкновенно повезло, что мы живем в век, когда еще можно делать открытия”. Р.Фейман.
Ход урока
1. Организационный момент.
Проблема строения атома остается актуальной и для современной науки. Элементарные частицы, ядро атома, атом, молекула – все это объекты микромира, не наблюдаемого нами. В нем действуют иные законы, чем в макромире, объекты которого мы можем наблюдать или непосредственно, или с помощью приборов.
2. Актуализация знаний: (слайд 3)
3. Изложение нового материала.
В истории развития физики одна из самых интересных и увлекательных страниц – это история открытия сложного строения атома. В конце XIX- начале XX в. идеи о строении атома витали в воздухе, различные догадки ученых создавали духовную атмосферу, в которой, в конце концов, и рождалось открытие, ведь в то время ничего о внутреннем строении атома не было известно.
Историческая справка – взгляды на строение атома
Модель Томсона нуждалась в экспериментальной проверке. (слайд 8, 9, 10)
Этой задачей занялся Эрнест Резерфорд (1871-1937 гг.) (слайд 11, 12, 13)
– английский ученый, известный своими исследованиями строения атома и радиоактивности, один из создателей атомной и ядерной физики. Резерфорд был членом Лондонского королевского общества – академии наук Англии, почетным членом более 30 академий и научных обществ разных стран мира, в том числе Академии наук СССР. В 1908 году он стал лауреатом Нобелевской премии за исследования радиоактивности. В 1931 г. Э. Резерфорд за свои научные заслуги стал пэром Англии, получив титул лорда Нельсона
В лаборатории Резерфорда были проведены следующие эксперименты
Ответ учащихся; Опыт Резерфорда – описание эксперимента (анализ слайда 14)
Результаты опыта (слайд 15, 16, 17) Приложение 6
Представление обучающимся интересной исторической справки: “О результатах своих исследований Резерфорд сообщил в феврале 1911 г. Через три месяца его доклад был опубликован, и мир узнал о новой, планетарной модели атома. Осенью того же года состоялся первый Сольвеевский конгресс в Брюсселе, на который приехали выдающиеся физики Европы: М. Планк, А. Пуанкаре, А. Эйнштейн, Х.А. Лоренц, В. Нернст и др. Среди приглашённых участников был и Э. Резерфорд. С волнением он ожидал оценки своей работы. И что же он услышал? Ничего. О предложенной им модели атома не было сказано ни слова. Вообще-то председательствующий на конгрессе Лоренц говорил о достоинствах атомной модели, только не резерфордовской, а той, “которая была предложена сэром Дж. Дж. Томсоном”. Таким образом, научный мир не принял всерьёз модель атома Резерфорда”.
“Я был поражен простотой аппаратуры, которую вы используете, и блестящими результатами, которые вы получили. Мне представляется гением тот, кто может работать со столь примитивным оборудованием и собирать богатую жатву, далеко превосходящую то, что бывало добыто с помощью самых тонких и сложных приборов.” Хантаро Нагаока. Из письма Резерфорду в 1911 г.
Для выяснения причин такого отношения учёного мира к результатам экспериментальной деятельности Резерфорда обучающимся предлагается самим разобраться в данном вопросе и возникших противоречий.
Вопрос учащимся: Каков характер противоречий данной модели атома с классическими представлениями? (слайд 21)
Таким образом, факт длительного существования атомов несовместим с планетарной моделью атома Резерфорда, если ее рассматривать с позиции классической электродинамики.
Постулаты Н.Бора. (слайд 22)
В 1913 году датский физик Нильс Бор предпринял попытку создания качественно новой модели атома, (но это тема следующего урока).
Учитель физики. Модель атома водорода и водородоподобных атомов по Н. Бору
Для невозбужденного атома радиус орбиты 


Каждой орбите соответствует определенная энергия электрона


Знак “-” указывает на связанность электрона с ядром атома, притяжение электрона к ядру.
Чтобы оторвать электрон от ядра атома водорода надо сообщить ему энергию 13,6 эВ
Энергетический спектр (слайд 27)
Смогла построить только модель атома Н (водорода), а для атомов других химических элементов – не удалось.
Противоречива, т.к. с одной стороны отвергаются законы классической физики (движение электрона по круговой орбите без излучения), а с другой – использование этих законов – уравнение движения. Движение электрона по орбитам в атоме не имеет ничего общего с движением планет Солнечной системы.
Объяснила линейчатые спектры только водородоподобных атомов.
Объяснила поведение атома в магнитном поле
По современным представлениям стационарные орбиты не представляют действительного движения в атоме. В мире микрочастиц нельзя говорить о траектории их движения.
Все вопросы нашли свое решение в КВАНТОВОЙ МЕХАНИКЕ (слайд 33, 34)
4. Отработка изученного материала.
А пока давайте вспомним, о чем мы говорили сегодня на уроке. (слайд 35)
1. В чём заключается сущность модели Томсона?
2. В чём заключалась идея опыта Резерфорда?
3. Объясните по схеме опыт Резерфорда по рассеиванию альфа-частиц.
4. Объясните причину рассеивания альфа-частиц атомами вещества.
5. В чём сущность планетарной модели атома?
6. В чем противоречивость модели атома Резерфорда?
Учащимся предлагается выполнить мини-тест или тест и заполнить карточки с моделями атомов по изученному материалу. (слайд 36) Приложение 10 Оценка за выполнение теста и заполнение карточки выставляется самими учащимися при взаимопроверке попарно
Выводы. Выставление оценок.
Продукт урока:
Основы строения атома. Просто о сложном
Все в мире состоит из атомов. Но откуда они взялись, и из чего состоят сами? Сегодня отвечаем на эти простые и фундаментальные вопросы. Ведь многие люди, живущие на планете, говорят, что не понимают строения атомов, из которых сами и состоят.
Естественно, уважаемый читатель понимает, что в данной статье мы стараемся изложить все на максимально простом и интересном уровне, поэтому не «грузим» научными терминами. Тем, кто хочет изучить вопрос на более профессиональном уровне, советуем читать специализированную литературу. Тем не менее, сведения данной статьи могут сослужить хорошую службу в учебе и просто сделать Вас более эрудированными.
Атом – это частица вещества микроскопических размеров и массы, наименьшая часть химического элемента, которая является носителем его свойств. Иными словами, это мельчайшая частица того или иного вещества, которая может вступать в химические реакции.
История открытия и строение
Понятия атома было известно еще в Древней Греции. Атомизм – физическая теория, которая гласит, что все материальные предметы состоят из неделимых частиц. Наряду с Древней Грецией, идеи атомизма параллельно развивался еще и в Древней Индии.
Не известно, рассказали тогдашним философам об атомах инопланетяне, или они додумались сами, но экспериментально подтвердить данную теорию химики смогли много позже – только в семнадцатом веке, когда Европа выплыла из пучины инквизиции и средневековья.
Долгое время господствующим представлением о строении атома было представление о нем как о неделимой частице. То, что атом все-таки можно разделить, выяснилось только в начале двадцатого века. Резерфорд, благодаря своему знаменитому опыту с отклонением альфа-частиц, узнал, что атом состоит из ядра, вокруг которого вращаются электроны. Была принята планетарная модель атома, в соответствии с которой электроны вращаются вокруг ядра, как планеты нашей Солнечной системы вокруг звезды.
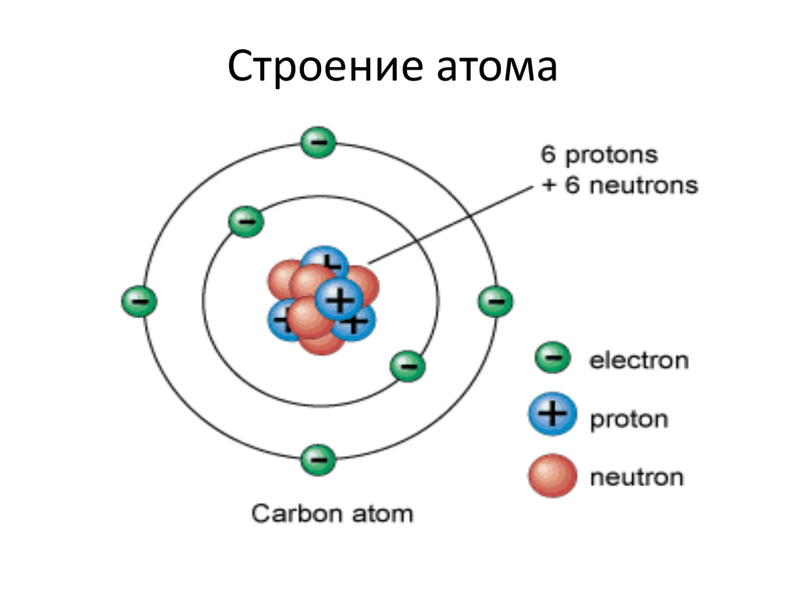
Ядро атома имеет положительный электрический заряд, а электроны, вращающиеся по орбите – отрицательный. Таким образом, атом электрически нейтрален.
Ниже приведем элементарную схему строения атома углерода.
Схема строения атома
Свойства атомов
Масса
Массу атомов принято измерять в атомных единицах массы – а.е.м. Атомная единица массы представляет собой массу 1/12 части свободно покоящегося атома углерода, находящегося в основном состоянии.
В химии для измерения массы атомов используется понятие «моль». 1 моль – это такое количество вещества, в котором содержится число атомов, равное числу Авогадро.
Размер
При этом, масштабы вещей таковы, что, по сути, атом на 99% состоит из пустоты. Ядро и электроны занимают крайне малую часть его объема. Для наглядности, рассмотрим такой пример. Если представить атом в виде олимпийского стадиона в Пекине (а можно и не в Пекине, просто представьте себе большой стадион), то ядро этого атома будет представлять собой вишенку, находящуюся в центре поля. Орбиты электронов при этом находились бы где-то на уровне верхних трибун, а вишня весила бы 30 миллионов тонн. Впечатляет, не так ли?
Если предсавить атом в виде стадиона, ядро будет размером с вишню в центре поля
Откуда взялись атомы?
В самом начале формирования Вселенной никаких атомов не было и подавно, существовали лишь элементарные частицы, под воздействием огромных температур взаимодействующие между собой. Как сказал бы поэт, это был настоящий апофеоз частиц. В первые три минуты существования Вселенной, из-за понижения температуры и совпадения еще целой кучи факторов, запустился процесс первичного нуклеосинтеза, когда из элементарных частиц появились первые элементы: водород, гелий, литий и дейтерий (тяжелый водород). Именно из этих элементов образовались первые звезды, в недрах которых проходили термоядерные реакции, в результате которых водород и гелий «сгорали», образуя более тяжелые элементы. Если звезда была достаточно большой, то свою жизнь она заканчивала так называемым взрывом «сверхновой», в результате которого атомы выбрасывались в окружающее пространство. Так и получилась вся таблица Менделеева.
Так что, можно сказать, что все атомы, из которых мы состоим, когда-то были частью древних звезд.
Почему ядро атома не распадается?
В физике существует четыре типа фундаментальных взаимодействий между частицами и телами, которые они составляют. Это сильное, слабое, электромагнитное и гравитационное взаимодействия.
Именно благодаря сильному взаимодействию, которое проявляется в масштабах атомных ядер и отвечает за притяжение между нуклонами, атом и является таким «крепким орешком».
Не так давно люди поняли, что при расщеплении ядер атомов высвобождается огромная энергия. Деление тяжелых атомных ядер является источником энергии в ядерных реакторах и ядерном оружии.
Итак, друзья, познакомив Вас со структурой и основами строения атома, нам остается только напомнить о том, что наши авторы готовы в любой момент прийти Вам на помощь. Не важно, нужно Вам выполнить диплом по ядерной физике, или самую маленькую контрольную – ситуации бывают разные, но выход есть из любого положения. Подумайте о масштабах Вселенной, закажите работу в Zaochnik и помните – нет поводов для беспокойства.