Раас в медицине что это значит
Раас в медицине что это значит
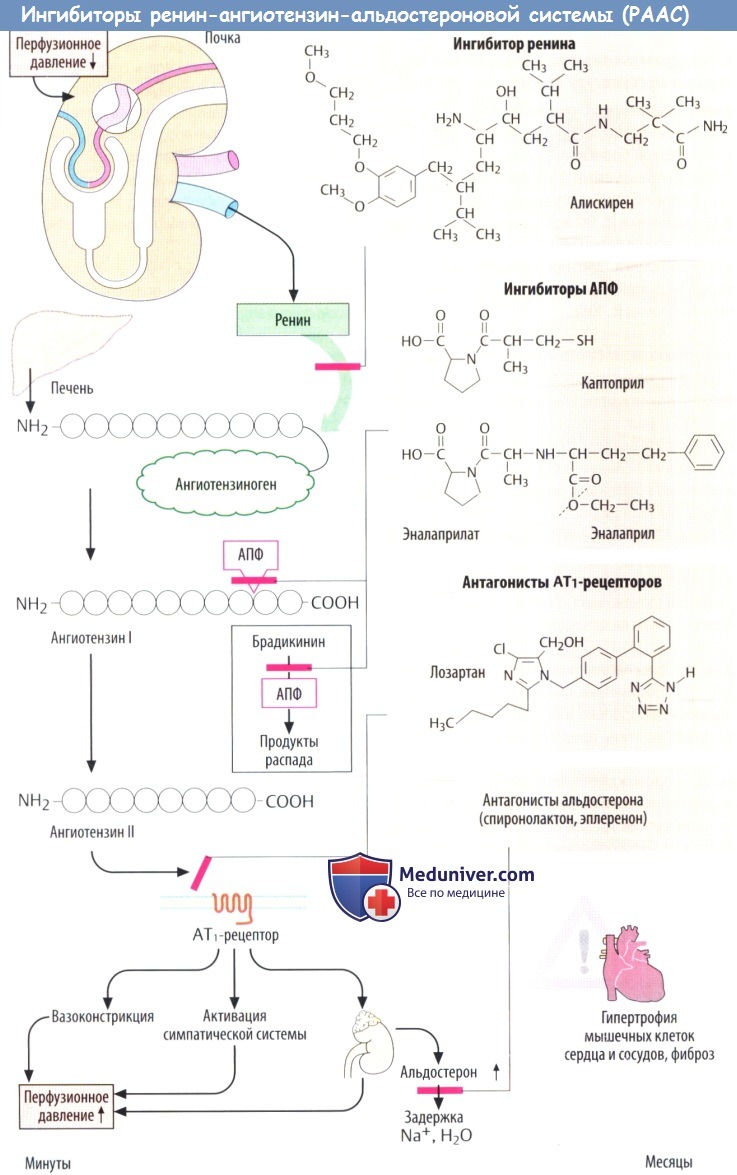
Ренин-ангиотензин-альдостероновая система (РААС) регулирует АД, а также натриевый и водный гомеостаз.
Ренин синтезируется специализированными гладкомышечными клетками в стенке приносящей артериолы почечного клубочка (юкстагломерулярный аппарат). Выброс ренина может быть обусловлен падением почечного перфузионного давления и симпатической активацией p-адренорецепторов в юкстагломерулярных клетках.
Как только ренин попадает в кровь, он расщепляет синтезируемый в печени ангиотензиноген до декапептида ангиотензина I. АПФ, в свою очередь, превращает ангиотензин II в биологически активный ангиотензин II.
АПФ, циркулирующий в плазме, локализуется на поверхности эндотелиальных клеток. Это неспецифическая пептидаза, способная отщеплять С-терминальные дипептиды от разнообразных пептидов (дипептидилкарбоксипептидаза). Таким образом, АПФ помогает инактивировать кинины, например брадикинин.
Ангиотензин II может активировать два разных рецептора (АТ1 и АТ2), связанных с G-белками. Наиболее значимое действие, которое ангиотензин II оказывает на сердечно-сосудистую систему, опосредовано АТ1-рецепторами. Ангиотензин II повышает АД различными способами:
1) сужением сосудов как артериального, так и венозного русла;
2) стимуляцией секреции альдостерона, приводящей к увеличению почечной реабсорбции NaCl и воды, а следовательно, и к увеличению ОЦК;
3) центральным повышением тонуса симпатической нервной системы, а на периферии — усиленным выделением и действием норадреналина. Длительное повышение уровня ангиотензина II может привести к гипертрофии мышечных клеток сердца и артерий и увеличению количества соединительной ткани (фиброз).
а) Ингибиторы АПФ, такие как каптоприл и эналаприл, занимают активный центр этого фермента, конкурентно ингибируя расщепление ангиотензина I. Эти препараты применяются при гипертензии и хронической сердечной недостаточности. Снижение повышенного АД обусловлено главным образом уменьшением образования ангиотензина II. Также свой вклад может вносить ослабление распада кининов, оказывающих сосудорасширяющее действие.
При застойной сердечной недостаточности после применения ингибитора АПФ повышается минутный объем сердца, т. к. вследствие падения периферического сопротивления уменьшается постнагрузка желудочков. Уменьшается венозный застой (предна-грузка), снижается секреция альдостерона и тонус венозных емкостных сосудов.
Побочные эффекты. Если активация РААС обусловлена потерей электролитов и воды (в результате лечения мочегонными препаратами, сердечной недостаточности или стеноза почечной артерии), применение ингибиторов АПФ вначале может вызывать чрезмерное падение АД. Достаточно часто наблюдается такой побочный эффект, как сухой кашель (10%), причиной которого может быть снижение инактивации кининов в слизистой оболочке бронхов.
Комбинация ингибиторов АПФ с калийсберегающими диуретиками может приводить к гиперкалиемии. В большинстве случаев ингибиторы АПФ хорошо переносятся и дают хороший терапевтический эффект.
К новым аналогам данных препаратов относятся лизиноприл, рамиприл.квинаприл, фозиноприл и беназеприл.
б) Антагонисты АТ1-рецепторов ангиотензина II («сартаны»). Блокада АТ1-рецепторов антагонистами подавляет активность ангиотензина II. Первым препаратом в группе «сартанов» был лозартан, вскоре были разработаны аналоги. К ним относятся кандесартан, эпросартан, олменсартан, телмесартан и валсартан. Основные (гипотензивные) эффекты и побочное действие такие же, как у ингибиторов АПФ. Однако «сартаны» не вызывают сухой кашель, т. к. не ингибируют распад кининов.
в) Ингибитор ренина. С 2007 г. на рынке появился прямой ингибитор ренина (алискирен), который можно использовать для лечения гипертензии. Этот препарат плохо всасывается после приема внутрь (биодоступность 3%) и очень медленно выводится (период полураспада 40 ч). Спектр его действия аналогичен антагонистам АТ1-рецепторов.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Раас в медицине что это значит
Другой причиной гипертензии, вызванной избыточным объемом жидкости в организме, является гиперсекреция альдостерона или, что случается реже, других стероидных гормонов. Небольшая опухоль в одном из надпочечников может секретировать большое количество альдостерона. Это состояние называют первичным альдостеронизмом. Альдостерон увеличивает реабсорбцию соли и воды в почечных канальцах. За счет этого происходит уменьшение диуреза и увеличение объема крови и внеклеточной жидкости. В результате развивается гипертензия. Увеличение потребления соли на этом фоне способствует еще большей гипер-тензии. Если такое состояние продолжается месяцы и годы, повышенное артериальное давление приводит к патологическим изменениям почек, в результате почки задерживают еще больше соли и воды помимо прямого действия альдостерона. Так часто развивается тяжелая гипертензия, приводящая к летальному исходу.
В случаях первичного альдостеронизма на ранних стадиях гипертензии сердечный выброс увеличивается, но на поздних стадиях он практически возвращается к исходному уровню, в то время как общее периферическое сопротивление вторично повышается.
Ренин-ангиотензиновая система. Ее роль в регуляции давления и развитии гипертензии
Кроме способности почек контролировать артериальное давление за счет изменения объема внеклеточной жидкости, почки имеют и другой мощный механизм регуляции давления. Это ренин-ангиотензиновая система.
Ренин — это фермент, который выделяется почками в случае падения артериального давления до очень низкого уровня. Ренин приводит к повышению артериального давления несколькими способами, устраняя таким образом первичное падение давления.
Ренин — это фермент, который выделяется почками в случае падения артериального давления до очень низкого уровня. Ренин приводит к повышению артериального давления несколькими способами, устраняя таким образом первичное падение давления.
На рисунке ниже показаны стадии активации ренин-ангиотензиновой системы и участие ее в регуляции артериального давления.
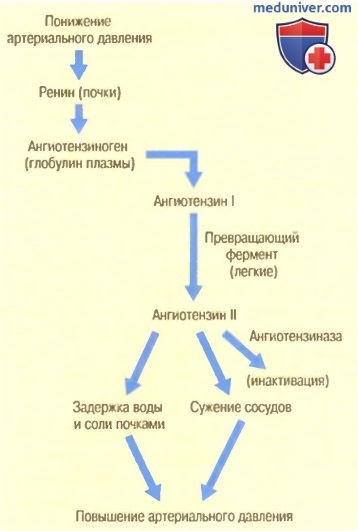
Ренин синтезируется и накапливается в неактивной форме (в виде проренина) в клетках юкстагломерулярного аппарата (ЮГА) почек. Клетки ЮГА представляют собой видоизмененные гладкомышечные клетки, расположенные в стенке приносящих артериол непосредственно перед капиллярным клубочком. Когда артериальное давление падает, собственный почечный механизм вызывает расщепление молекул проренина в клетках ЮГА и выделение ренина в кровь, протекающую через почечные сосуды. Таким путем большая часть ренина поступает в систему кровообращения. Небольшое количество ренина остается в тканевой жидкости почек и оказывает местное действие.
Ренин является ферментом. Ренин вызывает ферментативное расщепление другого белка плазмы крови — глобулина, который называют ангиотензиногеном. В результате образуется пептид, состоящий из 10 аминокислот, — ангиотензин I. Ангиотензин I является слабоактивным сосудосуживающим веществом и не оказывает значительного влияния на систему кровообращения.
Через несколько секунд или минут после образования ангиотензина I еще две аминокислоты отделяются от молекулы ангиотензина I, благодаря чему образуется ангиотензин II. Это преобразование почти полностью происходит в легких, пока кровь протекает через мелкие сосуды легочного круга кровообращения. Катализатором реакции служит ангиотензин-превращающий фермент (АПФ), присутствующий в эндотелии легочных сосудов.
Ангиотензин II является чрезвычайно активным сосудосуживающим фактором, который оказывает и другие влияния на систему кровообращения. Однако он сохраняется в кровотоке только 1-2 мин, а затем быстро инактивируется многочисленными ферментами под общим названием ангиотензиназ.
Находясь в кровотоке, ангиотензин II вызывает два принципиально важных эффекта, способствующих повышению артериального давления. Первый из них — сужение сосудов во многих сосудистых областях организма — развивается быстро. Сужение артериол приводит к увеличению общего периферического сопротивления и, следовательно, к увеличению артериального давления. Кроме того, умеренное сужение вен вызывает увеличение венозного возврата крови к сердцу, что стимулирует насосную функцию сердца.
Вторым эффектом ангиотензина, способствующим повышению артериального давления, является уменьшение экскреции соли и воды почками. Постепенное увеличение объема внеклеточной жидкости приводит к увеличению артериального давления в течение нескольких часов или дней. Это долговременное влияние с помощью механизма, регулирующего объем внеклеточной жидкости, является даже более мощным, чем быстрый сосудосуживающий эффект.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Артериальная гипертензия: обзор препаратов
Тонкости консультирования клиентов аптеки с рецептами на ингибиторы АПФ и сартаны
Артериальная гипертензия — самая распространенная сердечно-сосудистая патология, которой страдает около 40 % взрослого населения Европы [1]. Разумеется, это приводит и высокому спросу на антигипертензивные препараты независимо от сезона. И хотя в задачу первостольника прежде всего входит предложить несколько вариантов ЛС согласно выписанному в рецепте МНН, ему также предстоит разъяснять побочные эффекты, дозировку, а иногда и отвечать на вопросы об особенностях механизма действия. Поэтому мы решили предложить нашим читателям цикл статей о группе антигипертензивных препаратов и особенностях работы с запросами на них. Начнем с блокаторов ренин-ангиотензин-альдостероновой системы.
РААС: основа основ
Прежде чем приступить к описанию препаратов, ненадолго погрузимся в тонкости фармакологии и еще раз вспомним, каков механизм действия ренин-ангиотензин-альдостероновой системы, или РААС.
РААС — сложная гормонально-ферментативная система, в которую вовлечены практически все органы и ткани организма, но ключевые роли в ней принадлежат печени, почкам, надпочечникам и легким.
В печени постоянно синтезируется альфа-2‑глобулин ангиотензиноген. В то же время в почках вырабатывается фермент ренин в ответ на снижение внутрипочечного давления, снижение доставки натрия и хлора, а также на гипоксию. Он поступает, так же как и ангиотензиноген, в системный кровоток, где и связывается с ним с образованием ангиотензина I.
Ангиотензин I — вещество практически инертное. Он не действует на сосуды и является лишь предшественником активного компонента ангиотензина II. В образовании последнего наряду с ангиотензином I участвует ангиотензинпревращающий фермент (АПФ), который вырабатывается в легких.
Ангиотензин II — главное звено схемы РААС. Он проявляет мощный сосудосуживающий эффект и воздействует на органы-мишени, в которых расположены рецепторы к нему. Прежде всего речь идёт об эндотелии, сердце и почках. Вот почему высокий уровень ангиотензина II связан не только с повышением давления, но и с поражением сосудистой стенки, миокарда, почек и с развитием хронической сердечной и почечной недостаточности.
Кроме того, ангиотензин II вызывает усиление синтеза гормона надпочечников альдостерона. Последний участвует в контроле артериального давления (АД), регулируя гомеостаз калия, натрия и объема внутриклеточной жидкости. Под его влиянием повышается давление, увеличивается чувствительность гладких мышц сосудов к сосудосуживающим веществам, в том числе ангиотензину II.
Таким образом, РААС напрямую вовлечена в драму под названием «артериальная гипертензия», играя в ней одну из главных ролей. К счастью, существует возможность заблокировать эту систему. Сделать это позволяют препараты двух фармакологических групп — ингибиторы ангиотензинпревращающего фермента (иАПФ) и блокаторы рецепторов ангиотензина II (БРА, они же сартаны).
Первый класс препаратов — ингибиторы АПФ
Препараты этой группы стали одним из первых классов ЛС, которые эффективно снижают активность РААС, — их разработка началась еще в 60‑х годах прошлого века [2]. Сегодня они входят в категорию так называемых «лекарств, спасающих жизни» (life-saving drugs), в связи с доказанной способностью улучшать прогноз при ряде сердечно-сосудистых и почечных заболеваний [2].
Ингибиторы АПФ: механизм действия и эффект
Ингибиторы АПФ снижают уровень циркулирующего ангиотензина II за счет блокады ангиотензинпревращающего фермента, что обусловливает комплексный фармакологический эффект:
При приеме препаратов группы ингибиторы АПФ также улучшается углеводный обмен: повышается чувствительность тканей к инсулину и улучшается метаболизм глюкозы.
Показания и свойства
Спектр активности иАПФ позволяет использовать их при артериальной гипертензии, ишемической болезни сердца, хронической сердечной недостаточности, нефропатиях и остром инфаркте миокарда [3].
Ингибиторы АПФ относятся к группе антигипертензивных препаратов, которые определенно снижают АД и замедляют прогрессирование сердечной недостаточности, что определяет их широкое применение в кардиологии. Данные обзора с участием 158 998 пациентов с АГ показали, что прием иАПФ позволяет снизить смертность от всех вышеперечисленных причин. Это — существенное преимущество препаратов иАПФ, в том числе и по сравнению с блокаторами ангиотензина II [4].
Однако иАПФ все‑таки не способны полностью предотвратить превращение ангиотензина I в ангиотензин II, поскольку существует ряд других ферментов, которые успешно «заменяют» АПФ. Именно так работают, к примеру, ферменты химаза, эластаза и катепсин G [5]. При применении иАПФ эти вещества компенсаторно активируются, и блокада РААС становится неполной. Это — существенный недостаток иАПФ.
О чем предупредить клиента?
Важно! Во время консультации уместно подчеркнуть, что препараты, блокирующие активность РААС — иАПФ и БРА, — при постоянном применении наряду с антигипертензивным эффектом защищают сердце и сосуды, достоверно снижая частоту сердечно-сосудистых катастроф. Это маленькое замечание может послужить убедительным аргументом в пользу регулярного и дисциплинированного употребления таких ЛС, согласно инструкции и рекомендациям врача.
Ингибиторы АПФ: вспомним поименно
Рассмотрим особенности некоторых препаратов — представителей группы иАПФ.
Переносимость иАПФ
Предмет особого внимания первостольников, как специалистов, отпускающих препарат, — побочные эффекты иАПФ. Несмотря на в целом благоприятный профиль безопасности, неблагоприятные реакции — слабое звено препаратов этой группы.
О чем предупредить клиента?
Второй класс препаратов — блокаторы рецепторов ангиотензина II
Исследования, которые были сконцентрированы на изучении возможностей блокады РААС, привели к открытию группы препаратов, лишенных классического недостатка иАПФ — побочного эффекта в виде кашля. БРА, или сартаны, более полно блокируют РААС, за счет чего обеспечивают лучшую переносимость, чем их предшественники. Несмотря на относительно недавнее введение в клиническую практику — сартаны начали использоваться для длительного лечения АГ только в 1999 году, — представители этой группы сегодня стали одними из наиболее популярных антигипертензивных ЛС [12].
Сартаны: механизм действия и эффект
Фармакологический эффект сартанов идентичен эффекту иАПФ. За счет конкурентной блокады рецепторов ангиотензина II они подавляют вазоконстрикцию, секрецию альдостерона, уменьшают гипертрофию миокарда, а также улучшают функцию эндотелия.
Механизм действия БРА заключается не в блокаде ангиотензинпревращающего фермента, как в случае с иАПФ, а в блокаде рецепторов ангиотензина АТ1, через которые и реализуется подавляющее большинство физиологических эффектов ангиотензина II (вазоконстрикция и так далее). АТ1‑рецепторы расположены преимущественно в гладкой мускулатуре сосудов, сердце, печени, коре надпочечников, почках, легких и мозге.
За последние 10 лет появились препараты, которые некоторые специалисты предлагают выделить в отдельное, второе поколение БРА. Они не только блокируют АТ1‑рецепторы, но и способствуют нормализации обмена углеводов и липидов.
Показания и свойства
Сартаны, так же как и иАПФ, назначают при целом ряде заболеваний, в том числе при артериальной гипертензии, хронической сердечной недостаточности, перенесенном инфаркте миокарда, диабетической нефропатии, фибрилляции предсердий и метаболическом синдроме. Кроме того, БРА становятся препаратами выбора в ситуациях, когда на фоне приема иАПФ развивается кашель [13].
Доказана эффективность сартанов выраженно снижать артериальное давление и оказывать кардиопротективное действие [13, 14], а также:
Кроме того, некоторые БРА, так же как и иАПФ, снижают вероятность развития диабета и проявляют нефропротективный эффект.
Отдельные представители сартанов
Большинство сартанов имеет схожие свойства и мало чем отличается друг от друга как по фармакокинетическим показателям, так и по гипотензивной и кардиопротективной активности. Но всё же некоторые БРА имеют особенности:
Переносимость сартанов
БРА отличаются хорошей переносимостью, в том числе и по сравнению с иАПФ, поскольку не вызывают кашель. Высокий профиль безопасности препаратов этой группы — залог приверженности больных лечению и успешного результата. Побочные эффекты, которые могут возникать при приеме сартанов, обычно мало выражены. Как правило, они носят преходящий характер и редко становятся основанием для отмены лечения.
О чем предупредить клиента?
В заключение еще раз подчеркнем: иАПФ и БРА доказали и гипотензивный, и кардиопротективный эффект. Подавляющее большинство препаратов этих групп (за исключением фимасартана) сегодня применяется для лечения широкого спектра сердечно-сосудистых заболеваний. Единственное важное условие их эффективности — регулярный, длительный прием и соблюдение всех рекомендаций врача. Напомнив об этом посетителю с рецептом на иАПФ и БРА в конце консультации, первостольник выполнит свой профессиональный долг, приобретет лояльного клиента, а заодно внесет свой вклад в борьбу с одним из самых распространенных заболеваний в мире.
Нашли ошибку? Выделите текст и нажмите Ctrl+Enter.
РААС и фиброз. Реалии и перспективы
Стенограмма выступления профессора Драпкиной О.М. на II Международном Интернет Конгрессе специалистов по внутренним болезням (день 2).
Профессор Драпкина О.М.: – Мы продолжаем, и дальше я сделаю сообщение, которое будет касаться ренин-ангиотензин-альдостероновой системы и возможного ее влияния на процессы фиброза. Я сразу приступлю…
(00:15) Заставка: РААС и фиброз
Ренин-ангиотензин-альдостероновая система – это часть того самого печального сердечно-сосудистого континуума, к которому мы привыкли. Хорошо известны действующие лица, это ангиотензиноген, ангиотензины I и II, альдостерон и два фермента, один из которых настоящим ферментом, в общем-то, и не является, я говорю о ренине, а второй настоящий фермент, ангиотензинпревращающий фермент, который служит мишенью для излюбленного класса препаратов кардиологов, терапевтов и других специалистов.
Конечно, путь к тому, чтобы открыть не только каждый из компонентов ренин-ангиотензин-альдостероновой системы, но и всю слаженную ее работу, был достаточно труден, но, тем не менее, неуклонно ученые шли к тому, чтобы разгадать эту загадку. Началось все в 1898 году, когда было обнаружено, что вытяжка из почек кролика способна повышать артериальное давление, это был как раз ренин. Затем наступили 1939 и 1940 годы, тогда был открыт ангиотонин, так его раньше называли, впоследствии он был известен и нам он известен как ангиотензин. Затем был выделен ангиотензин, и наконец, было выдвинуто предположение – это предположение затем было реализовано в соответствующий класс препаратов – о том, что существует некий фермент, блокирование которого приведет к тому, что ангиотензина II образуется меньше. Это как раз тот самый ангиотензинпревращающий фермент.
И потом мысль человеческая привела к тому, что были созданы препараты, которые способны влиять на различные уровни ренин-ангиотензин-альдостероновой системы. Это и ингибиторы АПФ, и первый ингибитор АПФ был получен из яда бразильской змеи жарарака, маленький портрет которой представлен на этом слайде. Наконец, где-то через 10 лет был создан первый непептидный пероральный блокатор ангиотензиновых рецепторов.
Еще раз посмотрим на главных героев ренин-ангиотензин-альдостероновой системы, я кратко охарактеризую каждого из них. Про ангиотензиноген, наверное, говорить приходится меньше, здесь больше роль отводится ренину, который и стимулирует эту реакцию, это превращение ангиотензиногена в ангиотензин I. И затем нас интересует, конечно, ангиотензин II, который и реализует основные неблагоприятные эффекты активации ренин-ангиотензин-альдостероновой системы. И мы видим, что есть еще и альдостерон, и про него тоже не следует забывать практикующему врачу.
Давайте посмотрим на портреты главных героев. Это действительно портрет, в беленькой рамочке, так выглядит ренин. Происходит от латинского ren – «почка», и понятно, что вырабатывается он в почках, в юкстагломерулярном аппарате в стенках артериол почечных клубочков. Оттуда он поступает в кровь и лимфу и начинает уже свое действие. Как я уже сказала, ренин не является истинным гормоном, поскольку не имеет клеточной мишени, а воздействует на другой белок – это единственная его мишень, белок ангиотензиноген. Он присутствует в матке, в плаценте, в слюнных железах, в мозге, в стенках некоторых крупных артерий и представляет из себя 340 аминокислот с молекулярной массой 37 кДа.
Следующий очень важный агент – это ангиотензин II, тоже его портрет в уголке есть. Здесь их две структуры, потому что первая структура – это ангиотензин I, а вторая структура, от которой уже отщепилось несколько остатков – это ангиотензин II. Он известен под разными именами: он же ангиотонин, он же гипертензин – мы чаще называем эту группу ангиотензинами. Это пептид, который образуется в организме из ангиотензиногена, и он обуславливает эффекты, которые тоже представлены на слайде. Это и вазоконстрикция, и усиление реабсорбции натрия в проксимальных почечных канальцах, и секреция альдостерона – без него она как будто бы невозможна, но мы чуть ниже посмотрим, что возможна и без него. Секреция вазопрессина, эндотелина-1 – это главные враги, или антиподы релаксирующего фактора из эндотелия, оксида азота. Высвобождение ренина, усиление высвобождения норадреналина из симпатических нервных окончаний, и наконец, пролиферация гладкомышечных клеток сосудов, гиперплазия интимы и гипертрофия кардиомиоцитов.
Таким образом, мы можем сказать, что действительно практически на каждом этапе так называемого сердечно-сосудистого континуума ангиотензин вносит свою роль. Это начинается на самых первых этапах этой печальной дороги, когда мы говорим о факторах риска. А факторы риска для всех неинфекционных заболеваний одни и те же.
Это высокий уровень артериального давления, это нарушение липидного обмена, это высокий уровень глюкозы и избыточная масса тела. Затем факторы риска реализуются в эндотелиальную дисфункцию, которой не видно, которая себя никаким образом не проявляет, но именно этот этап – самый лучший этап для того, чтобы внедриться в патологический процесс и повернуть его вспять. Если этого не происходит, то идет череда событий, таких как атеросклероз. Это заболевание, которое поражает сосуды крупного мышечного типа, и в первую очередь уязвимы сосуды коронарные. Ишемическая болезнь сердца, соответственно. Если вдруг происходит дестабилизация этой бляшки, которая была до поры до времени стабильной, то бригада скорой медицинской помощи доставляет такого пациента в отделение интенсивной терапии, поскольку бляшка изъязвляется, а это уже инфаркт миокарда. А дальше – как повезет. У кого-то возникнет миогенная дилатация, и пациент будет проявлять симптомы сердечной недостаточности. У кого-то рубец будет небольшим, и какое-то время ремоделирования миокарда не произойдет.
Поэтому для того, чтобы – возвращаемся к героям ренин-ангиотензин-альдостероновой системы – опосредовать свое действие, ангиотензин II должен связаться со специфическими рецепторами. И в основном таких рецепторов известно два типа, это ангиотензиновые рецепторы 1 и 2. Мы видим, что есть все основания – и это совершенно точно доказано – сделать так, чтобы заблокировать именно ангиотензиновые рецепторы 1 типа, потому что ангиотензиновые рецепторы 2 типа – это наши друзья, поскольку они существуют в «антагонистических» соотношениях с АТ1, и если АТ1 ответственны за вазоконстрикцию, то стимуляция АТ2 приведет к вазодилатации. Там задержка натрия – здесь выведение натрия. Здесь активация симпатоадреналовой системы и пролиферативные процессы – здесь обратный процесс, антипролиферативный эффект, противовоспалительный эффект. И надо сказать, что такие препараты тоже созданы, эти препараты влияют в какой-то степени избирательно – кто-то более избирательно, кто-то менее избирательно – на блокаду ангиотензиновых рецепторов 1 типа.
Есть еще один агент, это альдостерон. Альдостерон представляет из себя стероидную структуру, и физиологическая роль его известна давно, и не случайно мы практически в любой клинической ситуации, особенно когда пациент с сердечной недостаточностью, или он солечувствителен, или он солезависим, мы применяем блокаторы альдостерона, хорошо известные, которые есть в арсенале любого врача. Альдостерон представляет из себя гормон клубочковой зоны надпочечников, и он стимулируется в ответ на активацию ангиотензина II. Но обратите внимание, есть еще стимуляторы: это калий и, например, адренокортикотропный гормон. Он активирует минералокортикотропные рецепторы в цитоплазме и действует на уровне дистальных канальцев нефрона, вызывая те эффекты, за которые он отвечает, а именно, задержка натрия и воды, соответственно, объемозависимая гипертензия, экскреция калия, вывод его, и, как я уже сказала, задержка жидкости. Надо помнить, как я уже сказала, что помимо классической концепции, когда и ренин осуществляет свою работу, и ангиотензинпревращающий фермент осуществляет свою работу, и ангиотензина II образовалось много, и он стимулирует секрецию альдостерона (хотя лучше бы этого не было), если мы блокируем эту цепь, которая представлена на слайде слева от меня – у нас есть способы это заблокировать – то альдостерон все равно может вырабатываться под воздействием других факторов.
Как я уже сказала, высокий уровень калия, высокий уровень эндотелина, кортикотропина может приводить к тому, что альдостерона тоже будет много. Поэтому синтез альдостерона – это тоже тот факт, который надо учитывать, когда мы обдумываем схему ведения пациента с артериальной гипертензией. Рецепторы, которые чувствительны к альдостерону, найдены практически везде, поэтому мы тоже можем с определенной долей допущения сказать, что блокада альдостерона приведет к тому, что мы получим благоприятные эффекты активации ренин-ангиотензин-альдостероновой системы на так называемом тканевом уровне, не только плазменную, но и тканевую, которая и опосредует большие неприятности в плане, например, ремоделирования. Фиброз миокарда в основном связан, как мы немножко ниже увидим, именно с активацией ангиотензина II в большей степени и альдостерона.
Раннее ремоделирование левого желудочка после инфаркта миокарда, давайте представим себе эту ситуацию или вспомним эту ситуацию из нашей клинической практики. Первые часы, зона инфаркта есть, но нет пока клинически значимых изменений общей геометрии полости левого желудочка. А дальше все зависит от того, насколько быстро больной будет доставлен в специализированное отделение интенсивной терапии, скорее всего, пройдут часы. Мы видим, что зона пораженного миокарда расширяется, и та самая сферизация полости левого желудочка, конечно, требует не только месяцев, но начинается она через дни, поэтому здесь очень важно как можно раньше заблокировать ренин-ангиотензин-альдостероновую систему, например, в первые часы после инфаркта миокарда, и такие работы тоже есть и выполняются. Существенным моментом служит и то, что этот каскад – ангиотензиноген, ангиотензин II и связывание его с ангиотензиновыми рецепторами – имеет и некие альтернативные пути.
Например, если мы даже и блокируем ангиотензинпревращающий фермент, то возможно формирование или синтез ангиотензина II за счет АПФ независимого образования, и здесь самую большую роль играют химазы. Обратите внимание, образуется брадикинин. Мы не любим этот агент, поскольку он вызывает кашель у нашего пациента. Но если повнимательнее присмотреться уже к этому герою, мы увидим, как много положительных черт он в себе таит. Это вазодилатация, в том числе, коронарных артерий, это усиление натрийуреза, это кардиопротективное действие. Это увеличение фибринолитической активности плазмы крови, и это еще далеко не полный перечень. Брадикинин участвует в процессах цитопротекции в условиях гипоксии, стимулирует рост капилляров, а самое главное, является мощным индуктором для того, чтобы освободился оксид азота. Он тормозит высвобождение норадреналина из нервных окончаний симпатоадреналовой системы и таит в себе очень большой антифибротический потенциал, который тоже активно изучается.
Вот она, наша ренин-ангиотензин-альдостероновая система, если ее представить «в полной красе», и у нас появляются и есть огромные возможности ее заблокировать везде: и на уровне фермента ангиотензинпревращающего, и на уровне рецепторов, и даже появились ингибиторы вазопептидаз и прямые ингибиторы ренина, о чем сегодня тоже говорил Анатолий Иванович.
Нужно ли блокировать на разных этапах ее? Исследования последние говорят, что не стоит этого делать, поскольку концепция соединить, например, блокаторы ангиотензиновых рецепторов с ингибиторами АПФ себя не оправдала. Тому есть, например, подтверждение в исследовании ONTARGET, когда никаких благоприятных эффектов от этой комбинации не было получено, а когда попытались ингибиторы АПФ соединить с алискиреном (исследование ALTITUDE), тоже ничего хорошего не получилось. По-видимому, этого делать не стоит.
Но всегда возникают вопросы, и сейчас нам уважаемая Интернет-аудитория задала вопросы по поводу того, что же выбрать, выбрать ли блокаторы ангиотензиновых рецепторов или же ингибиторы АПФ? Для того чтобы ответить на этот вопрос, давайте мы еще раз вспомним, казалось бы, хорошо знакомую нам схему. Вы видите, сигнализируют нам пути образования ангиотензина II, и если мы применяем блокаторы ангиотензиновых рецепторов, то ангиотензин II увеличенный начинает связываться с АТ2 рецепторами, и действительно мы получаем, что гипертрофия миокарда снижается, ремоделирование сердца и сосудов снижается. Но появляются новые данные. Оказывается, немного повышаются провоспалительные хемокины, как будто бы несколько активируется процесс апоптоза кардиомиоцитов, и возникает вопрос: что еще? Может быть, мы еще не все знаем. Если происходит или если мы блокируем ангиотензинпревращающий фермент, то ангиотензин II действительно уменьшается, а его «остатки» будут связываться с тем, что есть, поровну.
На самом деле ангиотензиновых рецепторов намного больше, мы только лучше знаем первые два типа, АТ1 и АТ2 рецепторы, но их уже около семи. Если про АТ1 и АТ2, как я уже сказала, мы много знаем, то, например, функция АТ3 на 2011 год была не совсем известна, они мало изучены, и что будет, если ангиотензин II начнет связываться и с ними, пока не совсем ясно. АТ4 локализованы в головном мозге и участвуют в местной регуляции кровотока и в формировании памяти.
Поэтому, наверное, мы хотим или мы должны сделать так, чтобы этих знаний, немножко пока недостающих, было больше. Было несколько мета-анализов, которые говорили о том, что все-таки блокаторы ангиотензиновых рецепторов несколько хуже защищают от инфаркта миокарда, чем другие препараты, хотя надо сказать, что следующие мета-анализы показали, что нет оснований беспокоиться, тем не менее, об этом мы иногда помним.
В чем же, на мой взгляд, основное отличие? Это основное отличие как раз в том кашле, который мы очень не любим у наших пациентов. И действительно, когда он мучительный, сухой кашель, то мы вынуждены менять ингибиторы ангиотензинпревращающего фермента на блокаторы ангиотензиновых рецепторов, но здесь мы лишаемся тогда еще одного эффекта – хорошего действия оксида азота.
Давайте рассмотрим эту схему. Это клетка эндотелия, BK2-R – это брадикининовый рецептор, NO-синтаза эндотелиальная – это как раз та NO-синтаза, которая ответственна за выработку оксида азота в эндотелиальной клетке, и мы тоже очень хорошо знаем, за это в 1992 году была присуждена Нобелевская премия, за открытие роли оксида азота как сигнальной молекулы. При наличии L-аргинина и при активности эндотелиальной NO-синтазы происходит цепь реакций, которая приводит к тому, что образуется L-цитруллин и оксид азота.
Но если мы блокируем ангиотензинпревращающий фермент, даем ингибиторы АПФ, то количество кининов, брадикинина в частности, возрастает, это приводит к большей активации эндотелиальной NO-синтазы, и мы видим, что оксида азота образуется еще больше. Это дополнительный и кардиопротективный, и сосудистопротективный эффект. Безусловно, когда человек кашляет мучительно, я повторюсь, мы вынуждены отменять ингибиторы АПФ, но подумайте несколько раз перед тем, как это сделать, и если это легкое покашливание, то, на мой взгляд, нет убедительных мотивов для того, чтобы это сделать.
Как же связать ренин-ангиотензин-альдостероновую систему с фиброзом? Уже частично я коснулась этого вопроса, когда характеризовала каждый из агентов этого каскада. Для того чтобы сегодня не охватить – это будет невозможно, охватить все, куда приложил свою руку фиброз – я хочу сказать, что в основном я коснусь интерстициального фиброза. Вообще, его можно подразделить на интерстициальный и периваскулярный.
Что же такое фиброз? Фиброз – это преобладание синтеза коллагена над его распадом. Нас интересует, конечно, только структурный коллаген, нормальный коллаген. И для того, чтобы на это соотношение – либо преобладание синтеза, либо распад – на него влиять, необходимо знать, какова активность металлопротеиназ или их ингибиторов. История изучения этого вопроса берет свое начало еще с 1872 года, когда впервые был охарактеризован нежный фиброз, так называемый «артерио-капиллярный фиброз», который развивается при болезнях почек. В 60-е годы идет интенсивное изучение этого процесса, и Браунвальд уже изучает влияние ангиотензина на функцию сердца, появляются первые данные о взаимосвязи сахарного диабета, гипертензии и фиброза. И в XXI веке становится возможной количественная и, самое главное, неинвазивная оценка фиброза.
Теперь у нас портреты тех агентов, которые действуют на фиброз, и как будто бы мы здесь не замечаем того, что видели при активности ренин-ангиотензин-альдостероновой системы, за исключением последнего портрета – профибротические цитокины, и это как раз TGF beta, трансформирующий фактор роста бета-типа. Коллаген – чрезвычайно твердая субстанция, он представляет из себя множество сшитых вместе стержнеобразных молекул. Они образуют столь прочные соединения, которые сравнимы приблизительно с прочностью стали. И понятно, если он образовался, то очень трудно повернуть вспять этот процесс.
Тем не менее, основной белок волокнистой ткани – это как раз коллаген, и он составляет до 30% всех белков тела человека. Синтез коллагена подразумевает влияние и на уровне саркоплазматического ретикулума, и на уровне самой клетки. Мы видим, что здесь необходима нормальная работа комплекса Гольджи, а также процессы гидроксилирования и гликозилирования, которые происходят после того, как произошел экцоцитоз.
На данном слайде представлены ультраструктурные микрофотографии фрагментов миокарда и левого предсердия и левого желудочка. Мы видим, что коллагеновые волокна образуются в пространстве между отростком фибробласта и капилляром. То есть, процессу фиброза подвержен весь миокард, и миокард предсердий, и миокард желудочков. Различные типы фиброза есть, и сегодня, если мы говорим о ренин-ангиотензин-альдостероновой системе, нас больше интересует именно реактивный фиброз. Верхняя часть, которая чередует участки кардиомиоцитов, изображенных красным цветом, и участки фиброза бледным голубым цветом. Конечно, реактивный фиброз – это, я бы сказала, закономерное осложнение гипертоника, который не лечился и у которого происходила хроническая активация ренин-ангиотензин-альдостероновой системы.
Фиброз, и именно фиброз, повинен в том, что такие пациенты часто демонстрируют суправентрикулярные нарушения ритма, и мы видим на срезе легочной вены – как раз там, в основном, происходит операция радиочастотной абляции – голубым цветом показан фиброз, пучки коллагена, которые окутывают легочную вену. Конечно, у такого пациента будет склонность к фибрилляции предсердия, и конечно, если он гипертоник, то артериальная гипертензия будет служить причиной его фибрилляции. У пациентов с артериальной гипертензией и с сахарным диабетом еще больше возможности иметь фиброз. При этом даже могут отмечаться так называемые «чистые» коронарные артерии, но ангинозные боли могут быть связаны с экстравазальной компрессией коронарных артерий, и здесь большая роль придается высокому уровню глюкозы, потому что этот высокий уровень приводит к тому, что образуются так называемые «сшивки» коллагена, и этот агент становится очень прочным.
Есть некоторые интересные факты, которые требуют переосмысления, я хочу их представить. На самом деле, ответа на них я не знаю. Может быть, наша уважаемая аудитория, которая сегодня нас смотрит, пришлет свои предположения по поводу того, что повышение активности матричной металлопротеиназы может приводить и к росту фиброза миокарда, потому что матричные металлопротеиназы могут перестраивать внеклеточный матрикс. Кроме того, есть убедительные данные того, что при хронической сердечной недостаточности фиброз может вызываться клетками костного мозга, которые по каким-то причинам мигрируют в миокард и дифференцируются в фибробласты, а не в кардиомиоциты. Вот факторы, которые влияют на фиброз.
Мы смотрим на стимуляторы и на ингибиторы и пытаемся найти те агенты, о которых сегодня уже говорили. Ангиотензин II есть, альдостерон есть в стимуляторах. И обратите внимание, в ингибиторах есть брадикинин и оксид азота. Если проанализировать влияние гормонов на функцию сердечных фибробластов, опять я обращаю внимание на ангиотензин II и альдостерон. Мы видим, что ангиотензин II больше повинен в аккумуляции коллагена, поскольку он действует положительно на синтез коллагена, стимулируя его, снижает при этом деградацию коллагена, и аккумуляция поэтому увеличивается. Альдостерон тоже действует на синтез коллагена, но практически не влияет на деградацию, и это приводит к тому, что вместо двух плюсиков (это весьма схематично) аккумуляция коллагена будет представлять из себя один плюсик. Если мы вспомним тех агентов, которые в основном ответственны за фиброз, там как раз был TGF beta 1 типа, и так все происходит в кардиомиоците. Здесь показан кардиомиоцит розовым цветом, а фибробласты изображены полигональными бледно-голубыми клетками. Если происходит активация ренин-ангиотензин-альдостероновой системы и ангиотензина II много, это приводит к тому, что активируется TGF beta, и его активация приводит к тому, что стимулы идут, активно вырабатываются фибробласты, которые в свою очередь приводят к синтезу межклеточного матрикса и к фиброзу.
Обратите внимание на другой подход к этой гипертрофии и к фиброзу. Оказывается, само по себе механическое растяжение тоже будет приводить к тому, что активируется TGF beta. Значит, если уже камера большая, она растянулась, или там есть высокое давление, сам по себе этот факт будет приводить к тому, что фиброз будет усиливаться, и соответственно, ремоделирование как минимум не будет уменьшаться. Поэтому нам, конечно, для того, чтобы быть эффективными, надо снизить и активность ренин-ангиотензин-альдостероновой системы, уменьшить концентрацию ангиотензина II, и каким-то образом воздействовать на ремоделирование миокарда, то есть уменьшать размеры этой большой камеры, снижать механическое растяжение.
Таким образом, совершенно точно доказана дружба между ангиотензином II и TGF beta – это так называемая профибротическая связка. Мало того, что ангиотензин II стимулирует TGF beta, он также может резко снижать активность матричной металлопротеиназы и влиять еще на некоторые процессы. Например, он может влиять на превращение фибробластов в миофибробласты и активировать фактор роста соединительной ткани.
На мой взгляд, удивительные данные на этом слайде представлены. Давайте вспомним пациента с гипертрофией, например, левого желудочка. Казалось бы, у них кардиомиоциты должны быть большие, либо в стадии гипертрофии, в стадии дистрофии, в стадии, может быть, воспаления. Но оказалось, что при гипертрофии левого желудочка размер кардиомиоцита даже уменьшается. Почему? Потому что все больший процент идет на внеклеточный матрикс, как раз на тот внеклеточный матрикс, который и ответственен за фиброз миокарда. Значит, гипертрофия, судя по этим данным, это в большей степени фиброз, нежели, например, перегрузка давлением, как мы тоже часто представляем.
Что происходит после инфаркта миокарда? Мы видели, что происходит с ренин-ангиотензин-альдостероновой системой, с ангиотензином II, с альдостероном. Оказывается, что рост плотности ангиотензинпревращающего фермента и рецепторов к ангиотензину после инфаркта миокарда резко увеличивается. Это тоже доказывает, что влияние раннее на активность, на блокирование этих рецепторов или ангиотензинпревращающего фермента должно быть полезным. Не может быть жестким сердце без жестких сосудов, поэтому фиброз сосудов – это тоже та область, которая чрезвычайно увлекательна, и есть причины повышения их жесткости при артериальной гипертензии. Но что сначала становится более жестким, периферия или центр – я имею в виде сердце, – конечно, на этот вопрос пока ответа нет.
Возникает такой вопрос: может ли фиброз иметь протективное значение? Да, может, если мы говорим о фиброзе в бляшке, потому что нам нужна, конечно, стабильная бляшка, а активация металлопротеиназ приводит к тому, что бляшка становится нестабильной. Коротко остановлюсь на том, что процессы фиброза одни и те же, во многом схожи и в сердце, и в печени. И обратите внимание, фиброз в печени тоже начинается с сосудов, потому что синусоиды теряют фенестрации, и именно с этого участка происходит фиброз печени. И сейчас все больше доказательств о том, что статины, в частности, розувастатин может влиять на фиброз печени и может быть полезным. Кроме того, блокирование эффектов ренин-ангиотензин-альдостероновой системы – это хорошо теперь не только для сердца, но это хорошо и для печени.
Ингибиторов много, можно выбрать любой. Анатолий Иванович сказал о том, что преимущества в данном случае, например, лизиноприла есть у действительно тучного пациента, у пациента с какими-то диффузными заболеваниями печени. И мы это подтвердили, проделав свое исследование, в которое вошли пациенты от 18 до 65 лет с артериальной гипертензией, и они имели патологию печени.
Что оказалось? Оказалось, что прием диротона, лизиноприла, с титрованием дозы от 5 до 20 мг в сутки был чрезвычайно благоприятен для них. Почему? Потому что, с одной стороны, его высокая эффективность приводила к тому, что мы обеспечили надежный контроль гемодинамики, а с другой стороны, все это привело к тому, что даже у пациентов с повышенным уровнем трансаминаз это не привело к дальнейшему ухудшению. Большое спасибо за внимание.